I-INTRODUCCIÓN Y EPIDEMIOLOGÍA
El ictus isquémico está causado por una disrupción del flujo sanguíneo a una o múltiples regiones del cerebro secundario a oclusión de un vaso sanguíneo,
lo cual ocurre en aproximadamente un 80% de los casos (20% son hemorrágicos)1.
Según datos del Instituto Nacional de Estadística (INE),
en España,
las enfermedades cerebrovasculares agudas o ictus fueron,
en el año 2006,
la segunda causa de muerte en la población española (32.887 casos en ambos sexos) y la primera causa de muerte en la mujer (19.038 casos),
así como la causa más importante de discapacidad permanente2,3.
En España se registran cada año aproximadamente 120.000 accidentes cerebrovascules7 y aproximadamente 795.000 en EEUU4.
En España en el año 2003 se alcanzó la cifra de 114.498 casos,
con una tasa de 268 por cada 100.000 habitantes y en el año 2006,
según esta misma encuesta del INE,
el ictus supuso 114.807 altas hospitalarias y 1.288.010 estancias hospitalarias,
esta última cifra superior a la de cardiopatía isquémica2.
En cuanto al coste,
en EEUU se estiman en 503.000 millones de dólares durante el año 2010,
incluyendo costes directos y perdida de productividad,
mientras que solo el coste hospitalario ronda los 155.700 millones de dólares4.
En España los costes oscilan entre los 801,7 y 1.243,9 millones de euros2.
En un análisis de coste-beneficio llamado el Modelo Markov se determina que en EEUU el tratamiento agresivo del ictus isquémico resulta en una reducción de 1,4 millones de dólares en costes de rehabilitación y de 4,8 millones de dólares en costes de cuidados generales por cada 1.000 pacientes5.
Epidemiológicamente,
el número necesario para tratar o “Number Needed to Treat (NNT)” en inglés es uno de los marcadores de efectividad de un tratamiento médico.
Esta cifra indica el número de pacientes que tienen que recibir tratamiento por cada resultado clínico favorable.
Se ha estimado que en EEUU el NNT incrementa de 2 durante los primeros 90 minutos de un ictus a 7 en las primeras 3 horas y hasta 14 en las primeras 4,5 horas6.
Por tanto,
de acuerdo con la Sociedad Española de Neurología (SEN),
“el tratamiento precoz (en España) supondría salvar la vida a más de 6.000 enfermos de los 40.000 que fallecen cada año”7.
En EEUU,
aproximadamente el 25-59% de los pacientes llegan a la sala de emergencia dentro de una ventana de 3 horas y un 33-66% lo hacen dentro de 6 horas8,9,
sin existir buenos datos epidemiológicos en España2.
De acuerdo con el documento “Estrategias en Ictus del Sistema Nacional Español”2,
a los 6 meses del ictus,
el 26,1% de los pacientes han fallecido,
el 41,5% son independientes y el 32,4% son dependientes.
Se calcula que entre los supervivientes del ictus el 44% quedan con una dependencia funcional2.
El pronóstico de los pacientes no depende tan solo de la severidad del ictus sino también de otros factores como la edad,
co-morbilidades preexistentes y complicaciones del ictus,
entre ellas epilepsia,
dolor central,
apnea de sueño,
infecciones del tracto urinario,
arritmias cardiacas,
etc.10
El paradigma de tratamiento actual permite el tratamiento del ictus isquémico con trombolisis intravenosa si el paciente se presenta dentro de una ventana de 4,5 horas desde el comienzo de sus síntomas,
siempre y cuando no tenga contraindicaciones,
conocidas como criterios de exclusión (tabla 1).
Para los pacientes que cumplen los requisitos de exclusión o que llegan a la sala de urgencias con sintomatología de más de 4,5 horas de duración,
no hay muchas alternativas de tratamiento disponible,
lo que aumenta significativamente el riesgo de muerte o discapacidad.
 TABLA 1– Criterios de exclusión de tratamiento con trombolíticos intravenosos.
TABLA 1– Criterios de exclusión de tratamiento con trombolíticos intravenosos.
En España hay una grave carencia de centros especializados en tratamientos avanzados de ictus isquémico.
Tan solo existe un centro en el 48% de las provincias.
La situación es especialmente crítica en Andalucía,
donde solo DOS de las ocho provincias cuenta con unidades de ictus7.
II- DIAGNÓSTICO
Realizaremos un breve resumen de los puntos claves del diagnóstico clínico del ictus isquémico,
ya que una valoración extensa de este tema va más allá del alcance de este estudio.
Estas referencias proporcionan excelentes repasos del diagnóstico clínico del ictus: "Australian Government.
National Stroke Foundation: Clinical Guidelines for Stroke Management 2010"11,
Ministerio de Sanidad y Consumo de España: Estrategia en ictus del Sistema Nacional de Salud2 y Sociedad Española de Neurroradiología: Guía de práctica clínica en neurorradiología: Ictus isquémico12.
Estas mismas fuentes explican en detalle los tratamientos preventivos y de rehabilitación disponibles para estos pacientes.
Diagnóstico clínico:
Se utilizan las escala de ictus (“stroke scale”) desarrollada por el Instituto Nacional de Salud (“National Institute of Health”) de EEUU llamada “National Institute of Health Stoke Score” o NIHSS (tabla 2) y la escala de Glasgow (tabla 3) para determinar la severidad del infarto isquémico.
Si el paciente sobrevive,
su nivel de discapacidad se contabiliza con la escala modificada de Rankin (“Modified Rankin Scale” o mRS por sus siglas en inglés,
tabla 4).
Aproximadamente 20% de estos infartos isquémicos presentan una escala NIHSS de 10 o más8 (tabla 5)13.
Se considera una buena recuperación post-ictus un mRS de ≤ 2.

TABLA 2- Escala de ictus isquémico del “National Institute of Health”,
cortesía del "National Institute of Neurological Disorders and Stoke".

TABLA 3- Escala de Glasgow, cortesía del "National Institute of Neurological Disorders and Stoke".
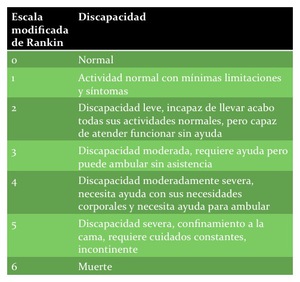
Fig. 3: TABLA 4- Escala modificada de Rankin.
TABLA 4- Escala modificada de Rankin.
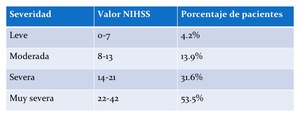
Fig. 4: TABLA 5- Porcentaje de valores NIHSS basado en severidad del ictus isquémico.
TABLA 5- Porcentaje de valores NIHSS basado en severidad del ictus isquémico.
Diagnóstico radiológico:
Una vez el paciente llega a la sala de urgencias y se activa el código ictus,
se realiza un TAC simple de cráneo sin contraste para descartar un infarto hemorrágico o infarto completado mayor de 1/3 del área del territorio de la arteria cerebral media (ACM) (imagen 1 y 2,
visualizando el signo de la arteria cerebral media densa en imagen 1),
que excluye al paciente del tratamiento trombolítico.
En casos de regiones de hipodensidad que demuestren un infarto completado,
el tamaño del mismo se puede estimar cuantitativamente utilizando el método ASPECT,
aunque cabe notar que este método de valoración es un poco oneroso y por ello no suele utilizarse1.
Podrían remitirse al artículo de Warwick et al14,
el cual expone el método ASPECT de forma asequible y detallada.
Si el paciente no muestra ningún signo radiológico o clínico que contraindique el tratamiento trombolítico,
se evalúa con un protocolo ictus que incluye imágenes de perfusión y angiografía con TAC o RM.
La tomografía computarizada es actualmente el método preferido por su rapidez y disponibilidad.
La ventaja de realizar una RM es que permite visualizar fácilmente las regiones de infarto agudo en secuencias de difusión (DWI),
aunque incluso éstas pueden ser normales si el infarto tiene menos de 1 hora de evolución.
Sus desventajas son la cantidad de tiempo que se tarda en adquirir las imágenes de RM,
sobre todo en el caso de ictus cerebral donde “el tiempo es cerebro” (“time is brain”) y su menor disponibilidad en comparación con TAC.
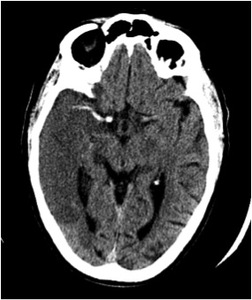
Fig. 5: IMAGEN 1- TAC sin contraste corte axial demuestra más de 1/3 de hipodensidad en el territorio de la ACM derecha. También visualizamos un trombo intraluminal hiperdenso en la ACM derecha conocido como el signo de la ACM densa. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 1- TAC sin contraste corte axial demuestra más de 1/3 de hipodensidad en el territorio de la ACM derecha.
También visualizamos un trombo intraluminal hiperdenso en la ACM derecha conocido como el signo de la ACM densa.
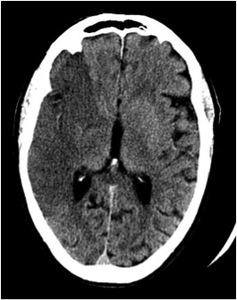
Fig. 6: IMAGEN 2- TAC sin contraste corte axial demuestra más de 1/3 de hipodensidad en el territorio de la ACM derecha. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 2- TAC sin contraste corte axial demuestra más de 1/3 de hipodensidad en el territorio de la ACM derecha.
Una vez adquiridas la imágenes del protocolo ictus,
se valora la imagen de angiografía para tratar de visualizar el trombo en toda su extensión (imagen 3,
trombo en arteria carótida interna (ACI) supraclinoidea derecha,
flecha azul; imagen 4,
trombo que ocluye la circulación en territorio de la arteria cerebral media (ACM) derecha,
flecha azul).
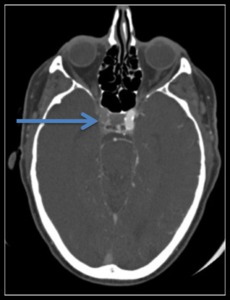
Fig. 7: IMAGEN 3- Angio-TAC corte axial demuestra oclusión de la ACI derecha (flecha azul). Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 3- Angio-TAC corte axial demuestra oclusión de la ACI derecha (flecha azul).
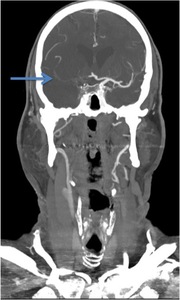
Fig. 8: IMAGEN 4- Angio-TAC corte coronal demuestra oclusión de la ACI y ACM derecha (flecha azul). Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 4- Angio-TAC corte coronal demuestra oclusión de la ACI y ACM derecha (flecha azul).
Después de identificar la localización del trombo (si es que se puede visualizar) se evalúan las imágenes de perfusión.
Hay tres parámetros y/o mapas de perfusión que se utilizan para determinar el tamaño de la región de isquemia.
El primer parámetro es el flujo sanguíneo o “cerebral blood flow (CBF)” que determina la velocidad del flujo sanguíneo; el segundo parámetro es el tiempo de tránsito medio o “mean transit time (MTT)”,
que mide el tiempo que tarda el bolo de contraste en pasar de la fase arterial a la fase venosa o,
en otras palabras,
el tiempo que tarda en perfundir una región del cerebro y finalmente el volumen cerebral o “cerebral blood volume (CBV)”,
que determina el volumen de sangre que irriga una región del cerebro,
incluyendo las arterias principales y las colaterales.
La relación entre estas tres entidades es:
MTT (min)= CBF (ml/g/min) ÷ CBV (ml/g)15
El primer mapa a valorar es el MTT,
ya que es el más sensible para visualizar un defecto de perfusión1.
Se valora el tamaño del defecto de perfusión en cada uno de estos mapas.
Los más importantes de contrastar son el CBV y el CBF.
Si existen defectos del mismo tamaño (“matching defects”,
imagen 5),
no hay circulación colateral y,
por tanto,
no hay tejido salvable.1
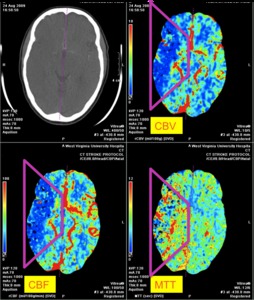
Fig. 9: IMAGEN 5- “Matching defect” en el territorio de la ACM derecha en los tres mapas de perfusión: MTT, CBV y CBF. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 5- “Matching defect” en el territorio de la ACM derecha en los tres mapas de perfusión: MTT,
CBV y CBF.
Si,
por el contrario,
un paciente que presenta síntomas de ictus isquémico,
no demuestra regiones de hipodensidad en TAC sin contraste (imagen 6),
demuestra un trombo intraluminal en angio-TAC (imagen 7,
flecha azul) y el defecto en el mapa de CBV es menor que en los otros dos mapas de perfusión,
entonces existe circulación colateral y por tanto el tejido está parcialmente perfundido y salvable (“mismatch defect”,
imagen 8,
ver cómo hay completa preservación del volumen sanguíneo cerebral).1
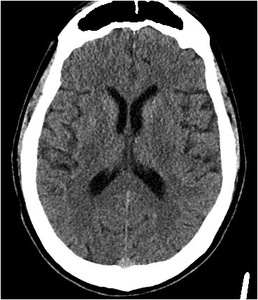
Fig. 10: IMAGEN 6- TAC sin contraste corte axial no demuestra hipodensidad o perdida de diferenciación de la materia gris y blanca. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 6- TAC sin contraste corte axial no demuestra hipodensidad o pérdida de diferenciación de la materia gris y blanca.
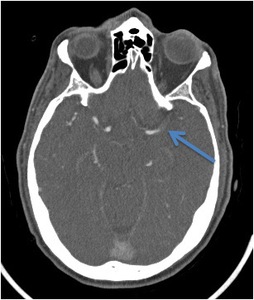
Fig. 11: IMAGEN 7- Angio-TAC corte axial demuestra oclusión de la ACI izquierda (flecha azul). Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 7- Angio-TAC corte axial demuestra oclusión de la ACI izquierda (flecha azul).
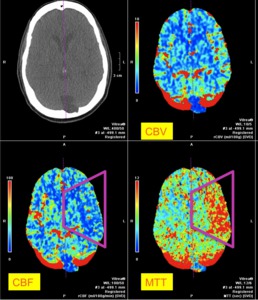
Fig. 12: IMAGEN 8- “Mismatching defect” en el territorio de la ACM izquierda en los tres mapas de perfusión: MTT y CBF demuestran defecto de perfusión mientras que el mapa CBV demuestra perfusión preservada. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 8- “Mismatching defect” en el territorio de la ACM izquierda en los tres mapas de perfusión: MTT y CBF demuestran defecto de perfusión mientras que el mapa CBV demuestra perfusión preservada.
III- TRATAMIENTO INTRA-ARTERIAL (IA)
En pacientes que no cumplen requisitos para el tratamiento con trombolisis IV porque presentan pasada la ventana de 4,5 horas o porque no recanalizan después de trombolisis IV,
el tratamiento IA es una opción.
Basado en las cifras de ictus isquémico en EEUU,
se estima que solo aproximadamente el 2,5% de los pacientes son susceptibles de una intervención intra-arterial (20.000 casos de los 795.000)8.
Las indicaciones generales incluyen pacientes que presentan entre 4,5 y 12 horas con trombos en arterias principales de la circulación anterior y de 4,5 hasta 24 horas en pacientes con trombos en las arterias principales posteriores,
y típicamente en pacientes con NIHSS entre 8-25 (déficit neurológico significativo).
Se ha determinado que los pacientes con NIHSS de menos de 10 no se benefician del tratamiento IA.8,16
La trombolisis intra-arterial (IA) ha sido valorada en múltiples estudios ya terminados (tabla 6) y actuales (tabla 7) y recomendada por la Asociación Americana del Ictus (“American Stroke Association”),
Asociación Americana del Corazón (“American Heart Association”) y Colegio Americano de Médicos Torácicos (“American College of Chest Physicians”) como un tratamiento adecuado para pacientes seleccionados.17 Para una lista exhaustiva de todos los ensayos clínicos relacionados al ictus,
se puede visitar la pagina web del “Internet Stoke Center”.18
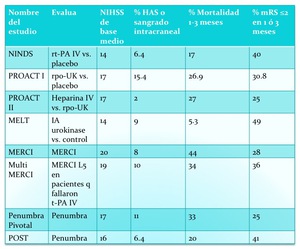
Fig. 13: TABLA 6- Ensayos clínicos ya completados que valoran los tratamientos IA.
TABLA 6- Ensayos clínicos ya completados que valoran los tratamientos IA.
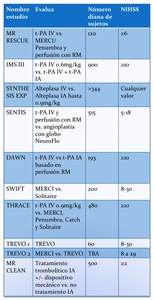
Fig. 14: TABLA 7- Ensayos clínicos actuales no completados que valoran los tratamientos IA.
TABLA 7- Ensayos clínicos actuales no completados que valoran los tratamientos IA.
La trombolisis intra-arterial se lleva a cabo de dos formas: 1) con agentes trombolíticos que trabajan en la cascada de coagulación plasminógeno a plasmina,
la cual degrada la fibrina de los coágulos o 2) a través de métodos mecánicos de extracción del trombo.
Estas dos formas de tratamiento también pueden ser utilizadas en conjunto.
Todos los tratamientos IA son administrados a través de un dispositivo que combina un microcatéter y un catéter guía.
Los primeros agentes trombolíticos utilizados se conocen como agentes de primera generación (uroquinasa y estreptoquinasa).
Éstos son activadores del plasminógeno,
pero han quedado fuera del mercado por causar hipofibrinoginemia,
que incrementa significativamente el riesgo de hemorragia masiva.
Los agentes trombolíticos de segunda generación (alteplasa y pro-uroquinasa) no son antigénicos y funcionan convirtiendo la proenzima plasminógeno en plasmina activa,
aunque solo la alteplasa se utiliza en tratamientos IA.
Los trombolíticos de tercera generación (reteplasa y tenecteplasa) son compuestos modificados de alteplasa,
y son trombolíticos más potentes que los de segunda generación ya que tienen una media vida más larga. Solo la reteplasa está aprobada por el FDA para el uso IA.6,19,20 (tabla 8).
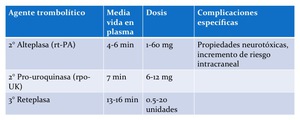
Fig. 15: TABLA 8- Agentes trombolíticos IA de segunda y tercera generación.
TABLA 8- Agentes trombolíticos IA de segunda y tercera generación.
Los métodos mecánicos de extracción de coágulos son especialmente útiles porque pueden obviar el uso de trombolíticos o significativamente disminuir su uso,
reduciendo las posibilidades de hemorragias clínicamente significativas.
Las desventajas son que estos dispositivos son mucho más inflexibles que los microcatéteres utilizados para la administración de trombolíticos IA y existe un mayor riesgo de disección y rotura o perforación del vaso sanguíneo,
así como de tromboembolismos proximales.6,21
Los dispositivos actualmente más utilizados y valorados científicamente son el MERCI (imagen 9),
Penumbra (imagen 10 y video Fig. 18),
Solitaire y AngioJet (imagen 11).
Solo MERCI y Penumbra están aprobados para su uso por el FDA,
aunque el AngioJet se utiliza de forma compasiva o “off-label”.
MERCI (Concentric Medical,
Mountain View,
CA,
EEUU): Fue el primer dispositivo desarrollado para la extracción mecánica de trombos,
recibió la aprobación del FDA en el 2004,
y ha tenido varias iteraciones,
la última es la serie V que tiene,
en comparación con su predecesor en espiral,
asas de alambres con tensión variable,
que permiten capturar de forma más eficiente el coágulo sanguíneo.
El dispositivo funciona insertando un microcatéter a través de un catéter guía,
atravesando el trombo con el microcatéter y dispositivo MERCI,
atrapando al coágulo entre sus alambres,
consiguiendo una extracción mecánica del mismo.
Se infla un globo justo distal al catéter guía para evitar tromboembolismos proximales.

Fig. 16: IMAGEN 9- Dispositivo MERCI serie V. Cortesía Dr. Thanh Nguyen.
References: Thanh N. Nguyen, Viken L. Babikian et al. Intra-arterial treatment methods in acute stroke therapy. Front Neurol 2011; 2:9.
IMAGEN 9- Dispositivo MERCI serie V,
cortesía Dr.
T.
Nguyen.
SOLITAIRE (ev3,
Plymouth,
Minnesota,
EEUU): En un mecanismo muy parecido al MERCI,
extrae los trombos utilizando una endoprótesis no cubierta asociada al microalambre guía,
atrapando el coágulo dentro de la endoprótesis.
PENUMBRA (Penumbra,
Alameda,
CA,
EEUU): Es un dispositivo que combina tanto una aspiración del trombo como una extracción mecánica.
Fue aprobado por el FDA para estos fines en el 2008.
Similar al MERCI,
se introduce a través de un catéter guía y se inserta hasta el nivel del trombo.
Usando una combinación de penetración del trombo con el microcatéter y aspiración se va extrayendo el trombo.
Al igual que el MERCI,
se infla un globo justo distal al catéter guía para evitar tromboembolismos proximales.
En la actualidad existen cuatro tamaños disponibles de microcatéter (0.054′,
0.041′,
0.032′,
y 0.026′),
que permiten tratar vasos sanguíneos de diferentes calibres,
aunque es importante mencionar que cuanto más pequeño es el microcatéter,
menos poder de aspiración tiene.6
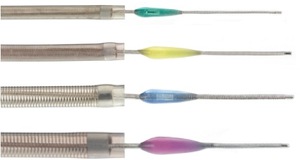
Fig. 17: IMAGEN 10- Dispositivos Penumbra en diferentes tamaños. Cortesía Penumbra, Inc.
References: Cortesía Penumbra, Inc.
IMAGEN 10- Dispositivos Penumbra en diferentes tamaños,
cortesía Penumbra,
Inc.
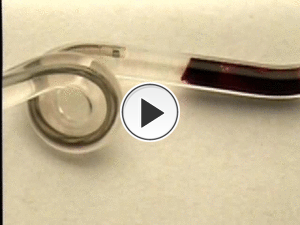
Fig. 18: Video funcionamiento Penumbra. Cortesía de Penumbra, Inc.
References: Cortesía Penumbra, Inc.
Video 1- Funcionamiento del dispositivo Penumbra,
cortesía Penumbra,
Inc.
ANGIOJET (Possis Medical,
Inc.,
Minneapolis,
MN,
EEUU): Funciona dirigiendo jets de salina a alta presión al coágulo a la misma vez que se aplica succión,
atrayendo el coágulo al catéter de evacuación.
Actualmente no está aprobado por el FDA,
aunque el AngioJet se utiliza de forma compasiva o “off-label”.
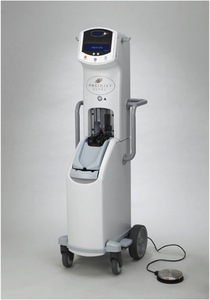
Fig. 19: Imagen 11- Dispositivo AngioJet. Cortesía Medrad Interventional / Possis
References: Cortesía Medrad Interventional / Possis
IMAGEN 11- Dispositivo AngioJet, cortesía MEDRAD Interventional / Possis.
Hay otros productos de extracción mecánica en el mercado que todavía no han sido aprobados por la FDA y que no reúnen tanta experiencia clínica,
como por ejemplo el “Catch Thromboembolectomy System” (Balt Extrusion,
Montmorency,
Francia,
Imagen 12); múltiples dispositivos de Phenox,
entre ellos el “Phoenox clot retriever”,
“CRC clot retriever CAGE”,
“BONNET”,
“BONNET short” y “pREset” (Phenox,
Bochum,
Alemania); el “Alligator” (Chestnut Medical Technologies,
Menlo Park,
CA,
EEUU); y “TREVO” (Concentric Medical),
que tiene un diseño y funcionamiento muy similar al SOLITAIRE.
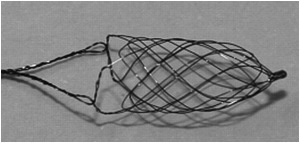
Fig. 20: IMAGEN 12- Dispositivo CATCH. Cortesía BALT Extrusion.
References: Cortesía BALT Extrusion
IMAGEN 12- Dispositivo CATCH, cortesía BALT Extrusion.
Asimismo se ha experimentado con angioplastia con globos (Hyperglide,
eV3,
Irvine CA,
EEUU y Gateway,
Boston Scientific,
Fremont CA,
EEUU,
entre otros) aunque éstos no son muy efectivos ya que hay una alta incidencia de re-estenosis y requieren tratamiento conjunto con otros agentes trombolíticos.6
Finalmente también se ha tratado a estos pacientes con endoprótesis permanentes22,
incluyendo el “Enterprise Stent” (Cordis,
Raynham,
MA,
USA,
imagen 13) entre múltiples tipos diferentes de endoprótesis,
pero éstos tienen el inconveniente de requerir anticoagulantes de por vida,
y además no existen estudios prospectivos de los efectos a largo plazo de tener una endoprótesis permanente.6 Por tanto,
es preferible utilizar endoprótesis removibles tipo Solitaire o TREVO.
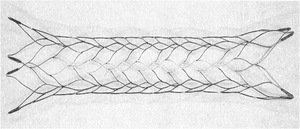
Fig. 21: IMAGEN 13- Endoprótesis Enterprise. Cortesía Cordis.
References: Cortesía Cordis
IMAGEN 13- Endoprótesis Enterprise,
cortesía Cordis,
Inc.
Los resultados clínicos son alentadores,
si bien aún es necesario validar estos tratamientos en poblaciones más amplias de pacientes.
En los ensayos clínicos realizados hasta ahora,
el 35% de los pacientes tratados con trombolisis IA tuvieron una recuperación normal o casi normal (NIHSS de 0-1) a los 90 días de tratamiento versus la población control.16,23 En un estudio de metanálisis de cinco ensayos clínicos randomizados se determinó que la trombolisis IA está asociada a una buena respuesta clínica de mRS 0-2 (43 vs.
28%; OR 2,
95% CI 1.3– 3.1; NNT 6.8) y una excelente respuesta clínica de mRS 0-1 1 (31 vs.
18%; OR 2.1; 95% CI 1.3–3.5; NNT 7.7).6,24
Obviamente,
estos tratamientos invasivos no son benignos.
Se estima que aproximadamente 10% de los pacientes tratados endovascularmente presentan sangrado intracraneal clínicamente significativo y,
de éstos,
el 50% son mortales.16,25 Se observan complicaciones clínicamente significativas en 5-7% de los casos más allá del sangrado intracraneal8.
Estos tratamientos también pueden causar insulto por reperfusión al tejido previamente isquémico,
que puede producir en edema intracraneal,
hemorragia intracraneal o muerte16.
Como ya hemos mencionado,
los dispositivos mecánicos tienen un incremento en la incidencia de ruptura o disección de los vasos sanguíneos,
de tromboembolismo proximal o distal o de sangrado subaracnoideo por rotura de los vasos sanguíneos,
lo cual ha sido observado en los ensayos clínicos con MERCI y Penumbra.26 En el ensayo clínico original de MERCI se observó un 4.3% de perforación de vasos sanguíneos.26
La escala que se utiliza para determinar el grado de recanalización y éxito del tratamiento está adaptada de la escala “Thrombolysis in Myocardial Infarction” (TIMI) utilizada en los cateterismos cardíacos y se conoce como “Thrombolysis in Cerebral Infarction” (TICI,
tabla 9).
Se considera un buen resultado un TICI de 2b o 3.

Fig. 22: TABLA 9- Escala TICI de reperfusión postratamiento.
TABLA 9- Escala TICI de reperfusión postratamiento.
El paciente con trombo en la ACM izquierda se presentó fuera de la ventana para el tratamiento con t-PA IV,
ya que se despertó con síntomas de ictus y no era certero el comienzo exacto de sus síntomas,
aunque sí se sabía que tenía una evolución de menos de 12 horas.
Se activó el código ictus para tratamiento intra-arterial.
Se realizó un angiograma diagnóstico (imagen 14) que confirmaba la presencia del trombo y falta de perfusión distal.
Después de tratamiento intra-arterial con el dispositivo MERCI se observa reestablecimiento del flujo sanguíneo TICI 3 (imagen 15 y 16).
Una resonancia post tratamiento (imagen 17) demuestra que la cantidad de tejido infartado es significativamente menor al tejido que demostró isquemia en las secuencias de perfusión (imagen 8).
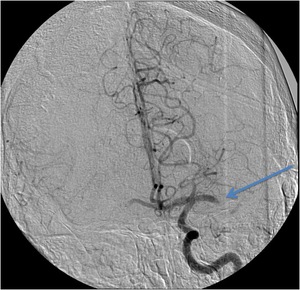
Fig. 23: IMAGEN 14- Angiograma convencional proyección AP demuestra trombo y falta de flujo distal en la ACM izquierda. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 14- Angiograma convencional proyección AP demuestra trombo y falta de flujo distal en la ACM izquierda.
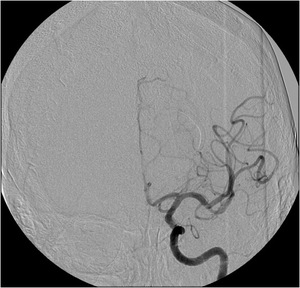
Fig. 24: IMAGEN 15- Angiograma convencional proyección AP demuestra restauración del flujo sanguíneo en la ACM izquierda luego de extracción del trombo con dispositivo MERCI. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 15- Angiograma convencional proyección AP demuestra restauración del flujo sanguíneo en la ACM izquierda luego de extracción del trombo con dispositivo MERCI.
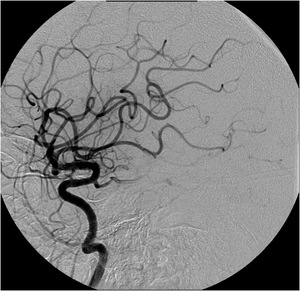
Fig. 25: IMAGEN 16- Angiograma convencional proyección lateral demuestra restauración del flujo sanguíneo en la ACM izquierda luego de extracción del trombo con dispositivo MERCI. Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 16- Angiograma convencional proyección lateral demuestra restauración del flujo sanguíneo en la ACM izquierda luego de extracción del trombo con dispositivo MERCI.
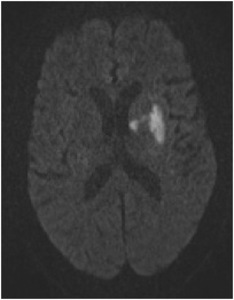
Fig. 26: IMAGEN 17- RM DWI demuestra que la región final de tejido infartado es significativamente menor a la región que demostró isquemia en mapas de perfusión (imagen 8). Imagen propiedad de Dr. Jeffery Hogg, West Virginia University.
IMAGEN 17- RM DWI demuestra que la región final de tejido infartado es significativamente menor a la región que demostró isquemia en mapas de perfusión (imagen 8).
IV- TRATAMIENTOS PUENTES
La trombolisis con t-PA IV ha sido valorada en múltiples estudios como un tratamiento de gran beneficio en pacientes con ictus agudo,
pero ha demostrado tener una efectividad limitada en pacientes con trombosis de las grandes arterias principales,
aún cuando se presentan dentro de la ventana de tratamiento de 4,5 horas.16 Tanto en estos pacientes,
como en pacientes con tratamiento intra-arterial,
hay un auge en el llamado “tratamiento puente” que combina la trombolisis intravenosa e intra-arterial o trombolisis intravenosa y la trombolisis intra-arterial mecánica.
Actualmente estos tratamientos puentes están siendo valorados por el “Interventional Management Stroke Trial III (IMS III)” en fase III de estudio,
donde se valoran dosis reducidas de t-PA IV seguido de tratamiento IA o el protocolo MR RESCUE,
donde se valoran dispositivos mecánicos de extracción de trombo (MERCI o Penumbra) versus tratamiento con trombolisis IV en pacientes que se presentan dentro de una ventana de 8 horas,
pero también valorarán el tratamiento puente de trombolisis IV dentro de una ventana de 4,5 horas + trombectomía mecánica en los pacientes que persisten con trombo en RM de seguimiento.
V- CENTROS ESPECIALIZADOS DE TRATAMIENTO DEL ICTUS Y SUS REQUISITOS
Tanto en España2 como en EEUU27 existen guías para la integración de múltiples sistemas (tanto de forma vertical como horizontal) de prevención,
tratamiento,
fase de rehabilitación y cuidados a largo plazo del ictus.
Éstas incluyen campañas de prevención,
instauración y activación del código ictus extrahospitalario llevada a cabo por personal de servicios de emergencia adiestrado,
código ictus intrahospitalario,
algoritmo de tratamiento en fase aguda en unidades especializadas de ictus,
unidades de rehabilitación y asistencia extendida.28
En EEUU hay dos tipos de clasificación de los centros que aceptan pacientes con ictus isquémico agudo.
La primera clasificación engloba los Centros de Ictus Primarios o “Primary Stroke Centers”29 y la segunda,
más avanzada,
hace referencia a los Centros de Ictus Avanzados o “Comprehensive Stroke Center”.
Hay múltiples diferencias entre ambos,
las más importantes son que en un Centro de Ictus Primario no hay disponibilidad de tratamiento IA,
ni un neurólogo de guardia 24 horas al día,
no siempre existe una unidad de ictus y no hay un neurocirujano de guardia presencial.8 (tabla 10)
|
Servicios
|
Centro Primario
|
Centro Avanzado
|
|
Personal entrenado en ictus “Equipo Ictus”
|
✓
|
✓
|
|
Algoritmo de tratamiento establecido
|
✓
|
✓
|
|
Sala de urgencias
|
✓
|
✓
|
|
Unidad Ictus de cuidados intensivos
|
Disponible o con centro de referencia cercano a donde derivar los pacientes una vez estabilizados
|
✓
|
|
Neurocirugía
|
Disponible en < 2h
|
✓
|
|
Neuroradiología (24/7)
|
✓
|
✓
|
|
Laboratorio (24/7)
|
✓
|
✓
|
|
Sistema de medición de calidad “QA” / Base de datos
|
✓
|
✓
|
|
Educación continua
|
Mínimo 8h / año
|
✓
|
|
Coordinación con servicios 061
|
✓
|
✓
|
|
Volumen específicos de casos anuales (20 sangrados subaracnoideos,
10 craniotomias para aneurismas,
15 endocoils para aneurismas,
25 tPA IV)
|
|
✓
|
|
Neuroradiología intervencional (24/7)
|
|
✓
|
|
Duplex carótido,
Doppler transcraneal
|
|
✓
|
|
Angio-MR (24/7)
|
|
✓
|
|
Ecocardiograma
transtorácica
/ transesofageal
|
|
✓
|
|
Programa de investigación
|
|
✓
|
|
Evaluación por pares “Peer Review”
|
|
✓
|
|
Sistema para coordinar servicios de rehabilitación
|
|
✓
|
TABLA 10- Servicios disponibles en los centros de ictus primarios vs.
avanzados
En España,
como ya hemos mencionado en la introducción,
hay unidades de ictus que grosso modo siguen las especificaciones de Centros de Ictus Avanzados de EEUU,
y sus requerimientos están especificados en la “Guía de Práctica Clínica en Neurorradiología – Ictus Isquémico” de la Sociedad Española de Neurorradiología12,
así como en “Estrategias en Ictus del Sistema Nacional Español” del Ministerio de Sanidad y Consumo de España.2 Lamentablemente solo en Cataluña hay un sistema comunitario establecido para derivar a estos pacientes desde centros primarios y secundarios a centros terciarios con Unidades de Ictus (Comunicación,
VII Curso de Neurorradiología,
Lleida,
España).
Como hemos visto en la introducción,
solo hay dos provincias en Andalucía con unidades ictus,
una carencia que necesita ser resuelta a la mayor brevedad posible,
aunque la Junta de Andalucía ha comenzado el proceso con la instauración del “Plan Andaluz de Ataque Cerebral Agudo (PLACA)”.30
En EEUU hay un sistema central establecido para ayudar a los centros que deseen adquirir y desarrollar la infraestructura necesaria para instaurar centros primarios o avanzados de ictus26,27,31 y éstos,
una vez establecidos,
son certificados por una entidad central nacional llamada el “Joint Commission”32 en colaboración con la Asociación Americana del Ictus y la Asociación Americana del Corazón [“Get with the Guidelines Program”].28 También existen rigurosos requisitos para la formación del personal médico que realiza intervenciones neurointervencionales,
véase en el artículo de J.J.
Connors et al.17



























