En la medicina actual las técnicas de diagnóstico por la imagen son imprescindibles no sólo en el diagnóstico sino en el tratamiento,
seguimiento y pronóstico de la mayoría de enfermedades.
Cada técnica de imagen tiene unos valores de sensibilidad y especificidad concretos dependiendo de la enfermedad y del órgano afectado.
Por otro lado,
sabemos que cada patología puede tener más de una forma de presentación en cada órgano en unos porcentajes que deberíamos conocer. Existen además presentaciones atípicas y enfermedades concomitantes que pueden alterar la presentación de la enfermedad y condicionar errores diagnósticos en la interpretación de los hallazgos radiológicos.
Estas afirmaciones son asumidas por los profesionales de todas las especialidades en mayor o menor grado.
Este trabajo es el fruto de una necesidad espontánea de autocrítica y de una preocupación creciente por lo que creemos que es una excesiva reiteración de errores diagnósticos en nuestro servicio.
En algunos casos ha sido la revisión de los hallazgos radiológicos para la discusión en los diferentes comités de tumores; en otros casos la revisión de sucesivas TC de control; en otros una divergencia clínico-radiológica-patológica y en otros la divergencia entre pruebas de imagen las que nos han alertado sobre la necesidad de revisar nuestras actuaciones.
Entre los factores que creemos que influyen en esta situación están la urgencia en la emisión de los informes,
la falta de concentración ante las continuas interrupciones durante el trabajo,
una incorrecta elección o ejecución de la técnica,
la no identificación de nuevas lesiones y,
probablemente la falta de conocimiento de las formas de presentación e historia natural de las enfermedades,
que nos orientan sobre lo que debemos ir a buscar en cada paciente,
y de las clasificaciones internacionales (p.e.
sistema TNM),
básicas para una correcta estadificación.
En este trabajo nos hemos centrado sobre todo en patología de abdomen porque constituye el mayor volumen de pacientes examinados en nuestro centro,
destacando sobre todo los pacientes con patología oncológica colorectal,
de vías urinarias y ginecológica.
Hemos intentado reflejar algunos de nuestros errores más frecuentes más allá de los pitfalls descritos con frecuencia en la literatura radiológica.
Con esta revisión queremos incidir en la importancia de revisar nuestro trabajo y en la relevancia que tenemos todos y cada uno de los radiólogos.
No nos ha sido posible aportar datos sobre la repercusión que han podido tener estos errores en el manejo de los pacientes pero,
quizás,
será nuestro siguiente proyecto de estudio.
Hemos organizado el texto unificando posibles fuentes de errores y pasos que podrían ayudarnos a evitar algunos de estos errores.
Se han incluido aquellas cifras o estadísticas que hemos creído que pueden alertarnos y concienciarnos de qué debemos buscar para encontrar patología.
Conocimiento de la enfermedad
Es importante conocer la historia natural de la enfermedad,
sus vías de diseminación y el riesgo de recidiva en función de la efectividad de los tratamientos previos.
Cada neoplasia tiene asociados unos porcentajes de diseminación en el momento del diagnóstico y unos porcentajes de recidiva local o a distancia.
En algunos casos la recidiva la podemos detectar nosotros sin que exista ninguna sospecha clínica.
Como ejemplos,
citaremos que el carcinoma de células renales tiene afectación metastásica en su presentación inicial hasta en el 33%,
que después del tratamiento quirúrgico radical de la neoplasia de vejiga existe recurrencia (pulmón,
pelvis,
hueso o hígado) en el 25% en una media de 12 meses y que a neoplasia colorectal intervenida con intención curativa recidiva en un 30% a nivel hepático en los 2 años siguientes a la intervención.
La TC es más útil en la detección de estas recidivas que los test de funcionalismo hepático o los niveles de CEA.
También es relevante conocer la expresión clínica y analítica de las enfermedades que nos obligaran a insistir en la búsqueda de la recidiva.
Destacamos que aunque el CEA es el marcador más específico para la recurrencia del carcinoma colorectal puede ser normal en hasta el 41% de los pacientes.
Por otro lado,
la elevación del CEA tras la cirugía de cáncer colorectal se asocia a recurrencia hasta en un 90% de los casos.
La importancia de descubrir esta recidiva radica en que hasta un 12-60% son quirúrgicamente resecables,
aumentando la supervivencia hasta los 80 meses.
TÉCNICA
Es importante planificar la secuencia de exploraciones a realizar dependiendo de la sospecha clínica.
A menudo la falta de coordinación entre servicios origina situaciones en las que por ejemplo una TC con resultado negativo pasa a ser positiva tras revisar las imágenes una vez se detecta neoplasia en la colonoscopia realizada posteriormente.
En este sentido la falta de distensión y de preparación del colon puede originar una infraestadificación o sobrevaloración de los hallazgos y no es infrecuente recomendar en el propio informe radiológico colonoscopias que son negativas o que finalmente muestran patología no neoplásica.
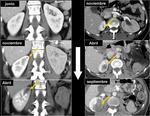
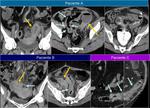
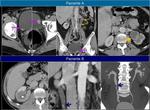
En esta situación es útil confirmar los hallazgos realizando un estudio retardado de la zona problemática.Fig. 1 Fig. 2 Fig. 3
Es necesario saber qué buscamos y adaptar las fases del estudio a esa patología; en toda neoplasia es necesario el protocolo de imagen que incluye una serie de fases vasculares.
En este sentido,
ante la detección de nuevos hallazgos respecto a estudios previos,
es importante primero confirmar que los estudios se hicieron en fases o con técnicas similares ya que pueden ser fuente de errores.
Fig. 4
Por otro lado,
queremos destacar la importancia de la fase de eliminación en el estudio de la neoplasia de la vía urinaria tanto en el diagnóstico inicial como en el control,
dado que un alto porcentaje de pacientes habrá sincronismo o segundas neoplasias en el seguimiento.
En muchos casos,
sólo seremos capaces de identificar la neoplasia en la fase de eliminación por tratarse de lesiones de pequeño tamaño.
Esto es especialmente importante en pacientes con hematuria o una citología de orina positiva.
Es importante conocer que en los carcinomas de cel.
transicionales de vías urinarias altas el tumor se localiza de forma más frecuente en la parte extrarrenal de la pelvis,
seguido por la región infundibulocalicilar con bilateralidad en el 2-4% de los casos.
En el 25% el tumor se localiza en el uréter,
y de éstos,
en el 50-70% aprox.
se encuentra en el tercio inferior, en el 15-25% en el tercio medio y en el 10-12% en uréter proximal,
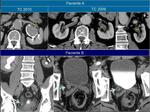
y no siempre se acompañan de dilatación retrógrada.Fig. 5
La imposibilidad de poner contraste ev por alergia o insuficiencia renal puede dificultar la identificación de las lesiones sobretodo hepáticas o renales y también puede hacer difícil diferenciar los implantes peritoneales de las propias estructuras intestinales.
En los casos en los que hay sospecha de alergia, ésta se tiene que confirmar con un estudio dirigido y se debe recurrir a otras técnicas de imagen como la RM o la ecografía que permitan completar de forma adecuada el estudio.Fig. 6 Fig. 7
Es importante conocer la naturaleza y aspecto de las lesiones para planificar el estudio. En este sentrido, en determinadas neoplasias mucinosas o quísticas y en determinados casos en los que interesa descartar carcinomatosis peritoneal,
el contraste oral positivo puede ayudarnos a discriminar implantes y adenopatías hipodensas.Fig. 8
En relación a la técnica,
creemos fundamental aprovechar la oportunidad,
siempre que dispongamos de ella, de trabajar con las estaciones de trabajo y con las herramientas que nos ofrecen (MIP,
reconstrucciones multiplanares) y no conformarnos con las estaciones visualizadoras que no disponen de estos recursos.Fig. 9 Fig. 10
Por otro lado,
la información anatómica que puede aportar la experiencia de trabajar con otras técnicas como la RM facilita mucho el entender e identificar las relaciones entre estructuras y,
particularmente en el caso de la pelvis,
poder delimitar lo que corresponden a espacios peritoneales y extraperitoneales.Fig. 11
NEOFORMACIÓN PRIMARIA
Factores predisponentes
Conocemos varios factores predisponentes para el desarrollo de neoplasias abdominales; entre las más conocidas están las poliposis,
la neurofibromatosis,
la hepatitis,
MEN,
etc.
Aquí destacamos por la relativa frecuencia con la que nos encontramos pacientes con estasis urinaria crónica (por ej.
en el sdme de la unión o uropatia obstructiva crónica litiásica) y pacientes con enfermedad renal crónica en fase de diálisis o poliquistosis adquirida ya que estas situaciones son factores predisponentes para la aparición de tumores de células transicionales y renales respectivamente.
Es importante conocer la forma de presentación de la tumoración primaria
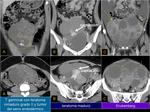
Si fueron tumoraciones muy hipodensas: Como ya se ha comentado en los tumores mucinosos o quísticos hemos malinterpretado muchas veces,
por su hipodensidad,
recidivas o implantes tumorales como colecciones.
Para evitar errores o detectar recidivas es importante conocer qué aspecto tenía la neoformación primaria.
Hay que sospechar de aquellas colecciones que recidivan constantemente,
que no mejoran con el tratamiento o que crecen tiempo después de la cirugía,
particularmente si lo hacen de una forma más o menos asintomática.
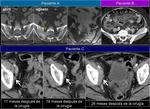
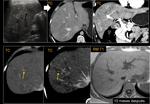
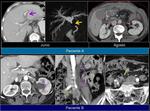
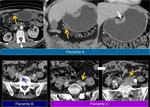
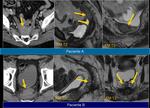
En los casos en los que se realiza punción o drenaje por sospecha de colección es recomendable añadir estudio anatomopatológico además del estudio microbiológico.Fig. 12 Fig. 13
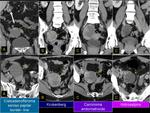
Si presentaban calcificaciones: Sabemos que hay tumores primarios que pueden presentar calcificaciones y no nos resulta extraño encontrarlas (tumores colorectales y ginecológicos),
pero es interesante saber que hasta en un 2-7% de los tumores transicionales de la pelvis renal pueden existir calcificaciones (superficiales o intratumorales,
puntiformes,
lineales o granulares que pueden simular litiasis,
ectasia tubular,
TBC o leucoplaquia).
La aparición de calcificaciones en los márgenes de resección,
en ganglios o en la proximidad de la lesión deben hacernos sospechar la recidiva.Fig. 14
Por otro lado,
algunos tumores presentan calcificaciones en respuesta al tratamiento de manera que pueden facilitar la identificación de focos de infiltración que fueron desapercibidos en el diagnóstico inicial.Fig. 15
Relaciones de proximidad
En la misma línea,
deberíamos saber también dónde estaba concretamente la neoplasia y su relación con las estructuras vecinas aunque no existiera invasión en el momento del diagnóstico ya que muchas veces la recidiva puede darse a ese nivel.
Es importante conocer si en la pieza quirúrgica quedaron márgenes infiltrados o próximos al margen de resección.
Fig. 16
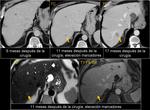
En el cáncer colorectal es importante prestar atención a aquellos casos en los que la neoformación primaria estaba en contacto o cercana a las fascias. Fig. 17
La anatomía patológica nos ayudará a reconocer neoplasias agresivas en las que ya en una fase postquirúrgica precoz pueden mostrar recidivas muy llamativas que no debemos confundir como complicación postquirúrgica.Fig. 18
Por otro lado,
existen peculariedades de cada paciente que,
aunque se traten de variantes constitucionales, debemos tener en cuenta ya que pueden explicar hallazgos poco frecuentes.Fig. 19
ESTUDIOS DE CONTROL
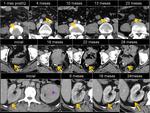
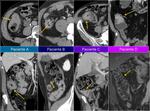
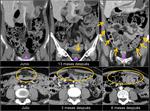
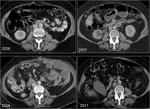
Deberíamos comparar no sólo con la TC inmediatamente previa sino con varias exploraciones previas: Para detectar crecimiento en los tumores con bajo índice mitótico es necesario valorar estudios en periodos no inferiores a un año.
Esto es particularmente complicado en aquellas lesiones de márgenes difícilmente medibles como,
por ej,
los que interpretamos como cambios o fibrosis postquirúrgica o postradioterapia.Fig. 20 Fig. 21
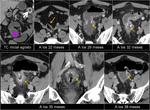
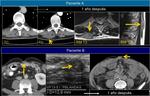
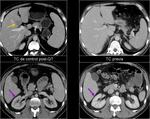
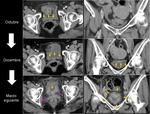
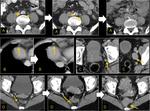
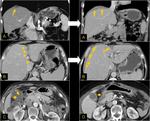
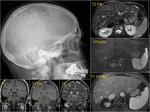
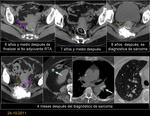
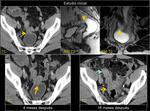
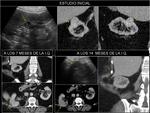
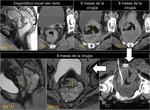
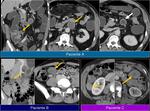
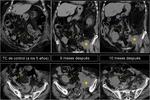
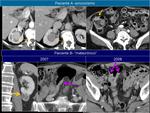
También es importante estar alerta en aquellos pacientes que por complicaciones en la cirugía presentaron colecciones postquirúrgicas ya que estas pueden ser malinterpretadas como recidivas locales.Fig. 22
De la misma forma,
la falta de crecimiento de lesiones interpretadas inicialmente como metástasis a pesar de la falta de tratamiento obliga a descartar otras causas. Fig. 23
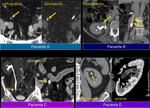
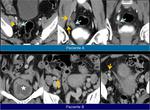
A la hora de comparar hallazgos entre estudios,
particularmente a la hora de buscar implantes,
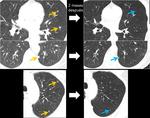
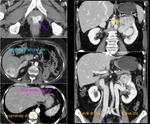
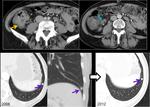
debemos tener en cuenta que el peritoneo está “en movimiento” y que a veces no hay que esperar ver las lesiones en la misma localización.Fig. 24 Fig. 25
TUMORES INCIDENTALES y SINCRONISMO-METACRONISMO
En primer lugar debemos ser conscientes de que existe la posibilidad de que el paciente tenga neoplasias sincrónicas o metacrónicas de diferentes órganos.Fig. 26
En el control de cualquier carcinoma se tiende a valorar con detenimiento la zona de la sutura o resección sin tener en cuenta que,
por ejemplo, en el CCrectal el riesgo de metacronismo es del 0,6-10%.
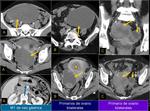
En el caso de los CCrenales más del 60% se descubren incidentalmente,
hasta el 6-25% pueden ser multifocales y la bilateralidad puede ocurrir en algún momento de la vida en el 4% de los pacientes,
particularmente el CCrenales papilar.
En el estudio de vías urinarias,
existe sincronismo en el 1-2% de los tumores de cel.
transicionales renales y en el 2-9% de los casos de TCT ureteral.
Del 11-13% de los TCT de tracto urinario alto desarrollarán lesiones metacrónicas en el tracto urinario alto y más del 50% desarrollarán tumores metacrónicos en la vejiga urinaria a los 2 años de la cirugía,
más frecuente en los casos de tumor primario en uréter que en riñón.
Es por esto que ante un tumor de vías,
altas o bajas,
debe pensarse en multiplicidad y en una tasa alta de recurrencia.Fig. 27
Por otro lado,
ante todo hallazgo sospechoso de neoformación de vías,
es importante valorar los antecedentes quirúrgicos recientes para no sobrevalorar los hallazgos en la TC.Fig. 28
HALLAZGOS NUEVOS
Ya hemos comentado que cuando hacemos el estudio comparativo y vemos un nuevo hallazgo,
aunque atípico debemos analizar bien si la TC previa realmente estaba hecha con la misma técnica.
En pacientes con neoplasias con alto potencial de diseminación,
cualquier nuevo hallazgo,
por inofensivo que parezca,
puede indicar diseminación.Fig. 29
La aparición de fístulas entre órganos vecinos, exista o no neoplasia previa,
es siempre un signo de alarma ya puede indicar un proceso infiltrativoFig. 30 .
Este hallazgo es especialmente significativo si la fistulización aparece en un lecho tumoral ya tratado,
ya que puede estar en relación a una complicación del tratamiento o puede indicar una progresión local; ante esta sospecha debe recomendarse aquella técnica de imagen que permita valorar mejor si existe un componente de partes blandas que sugiera tumor.
Cuando en un paciente con una neoplasia con tendencia a la diseminación local o peritoneal aparece un cuadro obstructivo,
sea de vía biliar o urinaria,
hay que considerar alguna de estas dos posibilidades y también adaptar la técnica de imagen adecuada.Fig. 31
El hecho de que haya transcurrido tiempo desde el diagnóstico la tumoración primaria tampoco debe excluir una recidiva tardía.
En caso de dobles neoplasias no siempre lo más frecuente es lo más probable.Fig. 32
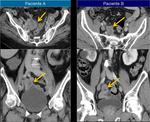
RECIDIVAS LOCALES
La recurrencia local en el cáncer colorectal en la zona de resección constituye el 25-44% de las recurrencias mientras que el 25-44% son metástasis a distancia La recurrencia anastomótica es del 2-4% en el cancer de colon y del 10% en el cancer de recto.
La mayoría de recurrencias ocurren en las partes blandas extramurales y carecen de componente intraluminal y por tanto no debemos confiar de aquellos casos con colonoscopia normal. En la literatura hemos encontrado que sólo en el 3,2% de los pacientes intervenidos de carcinoma rectal la recurrencia fue anastomótica intraluminal.
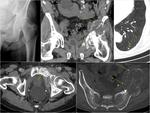
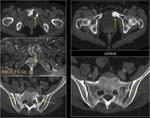
A nivel de vías urinarias,
es importante saber que existe la posibilidad de recurrencia en la uretra residual hasta en un 7% de los pacientes con cistoprostatectomía radical por n.
de vejiga.
Es la afectación prostática en el momento de la cistoprostatectomía el factor de riesgo más significativo para que exista recidiva uretral.
En la cirugía renal conservadora las tasas de recidiva en el parénquima residual son del 4-6%,
a los 6-24 meses cuando es un T3 pero puede verse incluso después de los 48 meses en un T2.
Las recurrencias son más frecuentemente como resultado de pequeños focos microscópicos de CRR multifocal.
La recurrencia local en el lecho de nefrectomía ocurre en el 20-40% de los pacientes,
típicamente en los primeros 5 años de la cirugía; y el riesgo es mayor cuando los márgenes de resección son incompletos y cuando los tumores son >5cm.
Cuando aparece la recurrencia local pocas veces es aislada y debe buscarse diseminación.
CAMBIOS POSTQUIRÚRGICOS Y POST RADIOTERAPIA
Debemos valorar con detenimiento los cambios postquirúrgicos y postRTA,
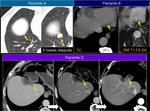
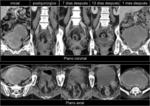
ser conscientes de que las estructuras pueden desplazarse ocupando los lechos de resección y trabajar con diferentes planos del espacio y comparar con varios estudios previos.Fig. 33
En el diagnóstico diferencial con la fibrosis postratamiento debe considerarse recidiva si se aprecia un crecimiento del componente de partes blandas,
crecimiento de adenopatías locoregionales o invasión de estructuras y en muchos casos sólo vamos a ser capaces de identificarlos correlacionando las imágenes de varios estudios consecutivos.Fig. 34
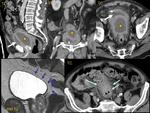
CARCINOMATOSIS
Se considera que aprox.
el 15% de los pacientes con cáncer de colon desarrollarán diseminación peritoneal; aunque muchos de ellos tendrán también diseminación hepática y pulmonar. En el 3% la diseminación será limitada al peritoneo y tendrán opción a cirugía citoreductora.
En el cáncer de ovario,
el 75% aprox.
desarrollarán diseminación peritoneal,
de los que el 50% estará limitada al peritoneo,
teniendo en algunos casos también opción a cirugía citoreductora.
La neoplasia de ovario,
a diferencia de la mayoría de tumores tendrá metástasis peritoneales más que parenquimatosas.
Es fundamental conocer las zonas más frecuentes de implantación y saber que existe cierto orden en el movimiento peritoneal que obliga a valorar algunas zonas con más detenimiento: los recesos rectouterino y rectovesical (50%),
el mesenterio del intestino delgado (40%),
el ileon terminal-válvula ileocecal y mesocolon sigmoide (20%),
la gotiera paracólica derecha (18%),
los espacios subdiafragmático derecho y hepatorenal y región umbilical.
Otras localizaciones frecuentes de diseminación son las cúpulas hepática y esplénica,
el saco peritoneal menor,
la fosa vesicular y la serosa del tracto gastrointestinal.
En las fases iniciales puede ser muy difícil visualizar carcinomatosis peritoneal.
No siempre va a existir líquido ascítico suficiente como para sospecharla.
Por otro lado,
la aparición de ascitis debe hacernos ir a buscar los signos más precoces de diseminación.Fig. 35 Fig. 36 Fig. 37
La afectación focal puede manifestarse como pequeños nódulos entre 5-20 mm,
masas peritoneales o placas a lo largo de los recesos y ligamentos peritoneales.
La forma difusa de afectación suele encontrarse en el omento,
donde vemos una obliteración de los planos grasos que puede oscilar entre un fino patrón nodular hasta una afectación sólida más clara “omental cake”.
En algunos casos,
los implantes pueden ser quísticos o mucinosos simulando líquido loculado.Fig. 38 Fig. 39 Fig. 40
ADENOPATÍAS
La estadificación ganglionar continua siendo un reto para el radiólogo porque si bien la sensibilidad para detectar ganglios por TC es muy alta la especificidad es muy baja.Fig. 41
Es básico conocer la frecuencia y distribución de la afectación ganglionar en los diferentes cánceres,
saber distinguir entre N y M en el estadiaje TNM y ser conscientes de que en caso de pacientes intervenidos con linfadenectomías las recidivas adenopáticas pueden ocurrir en sectores más distales.
Por otro lado,
existen determinados sectores en los que las adenopatías pueden pasar desapercibidas por la presencia de varias estructuras vasculares.Fig. 42
Dada la dificultad de identificar la afectación adenopática antes de que superen determinado tamaño o adquieran una morfología más sospechosa,
creemos que es importante comparar con detenimiento el aspecto ganglionar en los estudios consecutivos.
Debemos estar siempre alerta con los ganglios de los sectores más típicos de diseminación aunque inicialmente no nos parezca que cumplan criterios de malignidad.Fig. 43
HÍGADO
En determinadas situaciones en las que pueden coexistir lesiones de diferente naturaleza (lesiones benignas y malignas) sería aconsejable recomendar casi automáticamente completar el estudio con otras pruebas de imagen,
haya sospecha clínica o no de diseminación o recidiva.Fig. 44
Por otro lado existen áreas como son la cúpula hepática o las zonas de confluencia vascular,
en las que hemos visto como nos han pasado desapercibidas lesiones metastásicas con mayor frecuencia.Fig. 45
Ya se han descrito en numerosas ocasiones fenómenos vasculares hepáticos que simulan lesiones pero queremos hacer hincapié en aquellas lesiones de origen inflamatorio que pueden darse por ejemplo en pacientes oncológicos con obstrucción de vía biliar o con riesgo de colangitis por anastomosis bilioentéricas o por otras condiciones,
hemos malinterpretado como metástasis.
En estos casos, los estudios evolutivos son los que finalmente nos han hecho dudar de nuestro diagnóstico inicial.Fig. 46 Fig. 47
Por otro lado, en la búsqueda de lesiones metastásicas debemos tener en cuenta que las lesiones en diana,
por muchas que sean,
no son siempre malignas sobre todo si son un hallazgo incidental en un paciente asintomático y sin ninguna alteración analítica.
En estos casos es importante conocer contextos paralelos al neoplásico y claves radiológicas que nos pueden ser útiles.
(vasos atravesando las lesiones descritas sin desplazamiento de los mismos).Fig. 48
PULMÓN
A nivel pulmonar es importante saber que ni toda toda lesión claramente nodular es metástasica,
ni múltiples nódulos indican metástasis ni que un micronódulo aislado carece de importancia.
Aquí os presentamos algunos casos que lo reflejan y que nos recuerdan que debemos ser cautos,
estar pendientes de la evolución y sobre todo,
comparar con varios estudios previos. Fig. 49 Fig. 50 Fig. 51
OVARIOS
En relación a los ovarios,
únicamente destacar que en pacientes oncológicos,
particularmente aquéllos con patología del tracto gastrointestinal,
debemos valorar con detenimiento las áreas anexiales por la tendencia a diseminación ovárica de algunos de estos tumores.
En algunos casos,
la enfermedad neoplásica clínica se detecta por la afectación metastásica ovárica; por este motivo,
ante una lesión ovárica única o bilateral debemos ir a buscar también posible neoplasia primaria de otra localización.
Por otro lado,
los pacientes neoplásicos pueden presentar de manera sincrónica o metacrónica patología benigna o maligna primaria ovárica,
en muchos casos con aspecto superponible.
Aunque es importante la clínica en el momento del estudio de imagen, algunos casos con lesiones de origen aparentemente inflamatorio,
pueden pasar desapercibidos clínicamente y confundirnos en el diganóstico radiológico.
Debemos tener presente que la bilateralidad tampoco es definitorio de enfermedad metastásica.Fig. 52 Fig. 53 Fig. 54
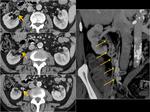
HUESO Y PARTES BLANDAS
En el apartado óseo,
sólo destacar que hay lesiones no metastásicas muy características que pueden afectar a los pacientes oncológicos sobre todo tratados con RTA (fracturas de estrés) o con fármacos que condicionan osteopeniaFig. 55 , pero queremos recordar que existen tumores radioinducidos y que pueden aparecer años después del tratamiento; en este sentido,
es fundamental conocer el campo de irradiación,
los márgenes quirúrgicos positivos que nos puedan hacer sospechar más una recidiva local,
y sobre todo estar pendientes de aquellas lesiones que no tiene un comportamiento característico de metástasisFig. 56 Fig. 57 .
Por otro lado,
recordar que es posible que coexistan lesiones,
neoplásicas o no,
de diferente naturaleza a la neoformación conocida (Paget,
mieloma,
etc).
Al considerar la diseminación M1 deberíamos tener en cuenta que, en raras ocasiones,
podemos encontrar M1 en las partes blandas. Muchas de estas lesiones pasan desapercibidas en el estudio radiológico a menos de que el paciente o el oncólogo nos orienten.Fig. 58 Fig. 59
TROMBOSIS VENOSAS
En pacientes oncológicos siempre debemos buscar posibles trombosis venosas ya que se ha descrito una incidencia 7 veces más alta que en la población no oncológica.
La enfermedad tromboembólica ocurre en todos los tipos de cánceres aunque los tumores con mayor riesgo son los de útero,
SNC y leucemia.
Por otro lado,
sabemos que algunos tumores tienen especial predilección por invadir las venas adyacentes,
como el carcinoma hepatocelular,
el carcinoma renal,
el cáncer de páncreas y,
a nivel torácico,
el carcinoma pulmonar y el linfoma,
que pueden condicionar el sdme de vena cava superior.
La trombosis venosa puede ser el primer signo de cáncer no conocido; la prevalencia de un cáncer oculto después de un episodio inexplicado de trombosis venosa es del 2.2-12%.
La trombosis venosa profunda no conocida y el embolismo pulmonar son frecuentemente hallazgos incidentales al realizar un estudio de extensión rutinario,
que se observa hasta en el 6.3% y 3,3% respectivamente,
y por tanto debemos estar siempre pendiente.
La patogenia de estas trombosis incluye un estado de hipercoagulabilidad secundaria a la producción de substancias procoagulantes, al estasis venoso por inmovilidad,
por compresión extrínseca por masas tumorales,
por lesión de la pared vascular venosa secundaria a invasión tumoral directa o por los catéteres intravenosos que directamente alteran la pared y producen una alteración del flujo.Fig. 60
 Siewert B,
Siewert B,
 Sosna J,
Sosna J,
 McNamara A,
McNamara A,
 Raptopoulos V,
Raptopoulos V,
 Kruskal JB.
Kruskal JB.
Missed lesions at abdominal oncologic CT: lessons learned from quality assurance.
Radiographics.
2008;28(3):623-38.
 Gollub MJ,
Gollub MJ,
 Panicek DM,
Panicek DM,
 Bach AM,
Bach AM,
 Penalver A,
Penalver A,
 Castellino RA.
Clinical Importance of Reinterpretation of Body CT Scans Obtained Elsewhere in Patients Referred for Care at a Tertiary Cancer Center.
Castellino RA.
Clinical Importance of Reinterpretation of Body CT Scans Obtained Elsewhere in Patients Referred for Care at a Tertiary Cancer Center.
 Radiology. 1999;210(1):109-12.
Radiology. 1999;210(1):109-12. Mahgerefteh S,
Mahgerefteh S,
 Kruskal JB,
Kruskal JB,
 Yam CS,
Yam CS,
 Blachar A,
Blachar A,
 Sosna J.
Peer review in diagnostic radiology: current state and a vision for the future.
Radiographics.
2009 ;29(5):1221-31.
Sosna J.
Peer review in diagnostic radiology: current state and a vision for the future.
Radiographics.
2009 ;29(5):1221-31. Larson DB,
Larson DB,
 Nance JJ.
Rethinking peer review: what aviation can teach radiology about performance improvement.
Nance JJ.
Rethinking peer review: what aviation can teach radiology about performance improvement.
 Radiology. 2011 Jun;259(3):626-32.
Radiology. 2011 Jun;259(3):626-32.- Browne RF,
Meehan CP,
Colville J,
Power R,
Torreggiani WC.
Transitional Cell Carcinoma of the Upper Urinary Tract: Spectrum of Imaging Findings
 1.
Radiographics.
2005;25(6):1609-27.
Review.
1.
Radiographics.
2005;25(6):1609-27.
Review.
- Vikram R,
Sandler CM,
Ng CS.
 Imaging and staging of transitional cell carcinoma: part 1,
lower urinary tract. AJR Am J Roentgenol.
2009;192(6):1481-7.
Review.
Imaging and staging of transitional cell carcinoma: part 1,
lower urinary tract. AJR Am J Roentgenol.
2009;192(6):1481-7.
Review.
- Vikram R,
Sandler CM,
Ng CS.Imaging and Staging of Transitional Cell Carcinoma: Part 2,
Upper Urinary Tract.
AJR Am J Roentgenol.
2009;192(6):1488-93.
Review.
 Prando A,
Prando A,
 Prando P,
Prando P,
 Prando D.
Urothelial Cancer of the Renal Pelvicaliceal System: Unusual Imaging Manifestations Radiographics.
2010;30(6):1553-66.
Prando D.
Urothelial Cancer of the Renal Pelvicaliceal System: Unusual Imaging Manifestations Radiographics.
2010;30(6):1553-66.- Ng CS,
Wood CG,
Silverman PM,
Tannir NM,
Tamboli P,
Sandler CM Renal Cell Carcinoma: Diagnosis,
Staging,
and Surveillance AJR Am J Roentgenol.
2008;191(4):1220-32.
Review.
 Lee EK,
Lee EK,
 Dickstein RJ,
Dickstein RJ,
 Kamta AM.
Imaging of Urothelial Cancers: What the Urologist Needs to Know AJR Am J Roentgenol.
2011;196(6):1249-54.
Kamta AM.
Imaging of Urothelial Cancers: What the Urologist Needs to Know AJR Am J Roentgenol.
2011;196(6):1249-54.- Lee MS,
Oh YT,
Han WK,
Rha KH,
Choi YD,
Hong SJ,
Yang SC,
Kim KW.
CT Findings After Nephron-Sparing Surgery of Renal Tumors. AJR Am J Roentgenol 2007;189(5):W264-71.
Review.
 Setlik DE,
Setlik DE,
 McCluskey KM,
McCluskey KM,
 McDavit JA.
Renal Cell Carcinoma Manifesting as a Solitary Bone Metastasis Radiographics.
2009;29(7):2184-9.
McDavit JA.
Renal Cell Carcinoma Manifesting as a Solitary Bone Metastasis Radiographics.
2009;29(7):2184-9. Choi YJ,
Choi YJ,
 Park SH,
Park SH,
 Lee SS,
Lee SS,
 Choi EK,
Choi EK,
 Yu CS,
Yu CS,
 Kim HC,
Kim HC,
 Kim JC.
Colonography for Follow-Up After Surgery for Colorectal Cancer AJR Am J Roentgenol.
2007;189(2):283-9.
Kim JC.
Colonography for Follow-Up After Surgery for Colorectal Cancer AJR Am J Roentgenol.
2007;189(2):283-9. Horton KM,
Horton KM,
 Abrams RA,
Abrams RA,
 Fishman EK.
Spiral CT of Colon Cancer: Imaging Features and Role in Management
Fishman EK.
Spiral CT of Colon Cancer: Imaging Features and Role in Management  1 Radiographics.
2000; 20(2):419-30.
1 Radiographics.
2000; 20(2):419-30. Fletcher JG,
Fletcher JG,
 Johnson CD,
Johnson CD,
 Krueger WR,
Krueger WR,
 Ahlquist DA,
Ahlquist DA,
 Nelson H,
Nelson H,
 Ilstrup D,
Ilstrup D,
 Harmsen WS,
Harmsen WS,
 Corcoran KE Contrast-Enhanced CT Colonography in Recurrent Colorectal Carcinoma Feasibility of Simultaneous Evaluation for Metastatic Disease,
Local Recurrence,
and Metachronous Neoplasia in Colorectal Carcinoma AJR Am J Roentgenol.
2002;178(2):283-90.
Corcoran KE Contrast-Enhanced CT Colonography in Recurrent Colorectal Carcinoma Feasibility of Simultaneous Evaluation for Metastatic Disease,
Local Recurrence,
and Metachronous Neoplasia in Colorectal Carcinoma AJR Am J Roentgenol.
2002;178(2):283-90. Shyn PB,
Shyn PB,
 Madan R,
Madan R,
 Wu C,
Wu C,
 Erturk SM,
Erturk SM,
 Silverman SG.
PET/CT Pattern Analysis for Surgical Staple Line Recurrence in Patients With Colorectal Cancer AJR Am J Roentgenol.
2010;194(2):414-21.
Silverman SG.
PET/CT Pattern Analysis for Surgical Staple Line Recurrence in Patients With Colorectal Cancer AJR Am J Roentgenol.
2010;194(2):414-21. Metser U,
Metser U,
 You J,
You J,
 McSweeney S,
McSweeney S,
 Freeman M,
Freeman M,
 Hendler A.
Assessment of Tumor Recurrence in Patients With Colorectal Cancer and Elevated Carcinoembryonic Antigen Level: FDG PET/CT Versus Contrast-Enhanced 64-MDCT of the Chest and Abdomen AJR Am J Roentgenol.
2010;194(3):766-71.
Hendler A.
Assessment of Tumor Recurrence in Patients With Colorectal Cancer and Elevated Carcinoembryonic Antigen Level: FDG PET/CT Versus Contrast-Enhanced 64-MDCT of the Chest and Abdomen AJR Am J Roentgenol.
2010;194(3):766-71. Pannu HK,
Pannu HK,
 Bristow RE,
Bristow RE,
 Cohade C,
Cohade C,
 Fishman EK,
Fishman EK,
 Wahl RL.
PET-CT in Recurrent Ovarian Cancer: Initial Observations Radiographics.
2004;24(1):209-23.
Wahl RL.
PET-CT in Recurrent Ovarian Cancer: Initial Observations Radiographics.
2004;24(1):209-23. Kyriazi S,
Kyriazi S,
 Collins DJ,
Collins DJ,
 Morgan VA,
Morgan VA,
 Giles SL,
Giles SL,
 deSouza NM.
Diffusion-weighted Imaging of Peritoneal Disease for Noninvasive Staging of Advanced Ovarian Cancer Radiographics.
2010;30(5):1269-85.
deSouza NM.
Diffusion-weighted Imaging of Peritoneal Disease for Noninvasive Staging of Advanced Ovarian Cancer Radiographics.
2010;30(5):1269-85. Anthony MP,
Anthony MP,
 Khong PL,
Khong PL,
 Zhang J.
Spectrum of (18)F-FDG PET/CT appearances in peritoneal disease.
AJR Am J Roentgenol.
2009;193(6):W523-9.
Zhang J.
Spectrum of (18)F-FDG PET/CT appearances in peritoneal disease.
AJR Am J Roentgenol.
2009;193(6):W523-9.- Khosa F,
Otero HJ,
Prevedello LM,
Rybicki FJ,
Di Salvo DN Imaging Presentation of Venous Thrombosis in Patients With Cancer.
AJR Am J Roentgenol.
2010;194(4):1099-108.
Review.
 Cronin CG,
Cronin CG,
 Lohan DG,
Lohan DG,
 Keane M,
Keane M,
 Roche C,
Roche C,
 Murphy JM.
Prevalence and significance of Asymptomatic venous Thromboembolic Disease Found on Oncologic Staging CTAJR Am J Roentgenol.
2007;189(1):162-70.
Murphy JM.
Prevalence and significance of Asymptomatic venous Thromboembolic Disease Found on Oncologic Staging CTAJR Am J Roentgenol.
2007;189(1):162-70.


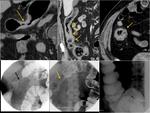
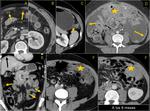
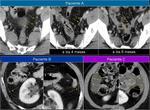
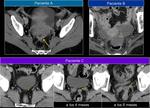
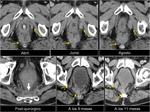
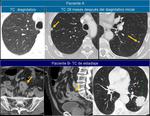
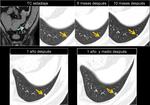
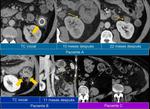
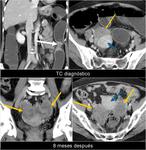
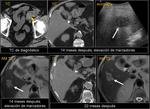
![Fig. 22: Paciente que acudió a urgencias por dolor lumbar irradiado a hemiabdomen izquierdo objetivándose una gran masa con componente quístico en cuerpo y cola de páncreas (asterisco) . Marcadores tumorales: CEA 0,74 ng/mL [0-3,4]; CA 19.9: 18,48 UI/mL [0-39]. En la cirugía se apreció una lesión quística septada bien encapsulada que había substituído el cuerpo y cola pancreáticos; se realizó exéresis tumoral con preservación del bazo. La AP mostró un tumor mucinoso border-line (neoplasia mucinosa quística con displasia moderada) con áreas de tipo endocervical y de tipo intestinal con focos de hemorragia y calcificaciones intratumorales. La superficie capsular estaba íntegra. Tras ser dada de alta reingresó a los 2 días por fiebre y dolor abdominal; la TC urgente ( imagen al mes de la cirugía)mostró varias colecciones abdominales en el lecho quirúrgico /flechas) que disminuyeron radiológicamente. En el seguimiento persistía una colección adyacente a bazo que en TC posterior habían disminuído (no mostradas.. En TC de control a los 3 meses de la cirugía control se constató la mejoría persistiendo alguna colección de localización periesplénica (sólo se muestra la que interesa por evolución indicada por una flecha). En la misma imagen se visualiza un hemangioma hepático (flecha). A los 14 meses se aprecia un crecimiento de la lesión que se consideró inicialmente como colección residual, y la aparición de una lesión hepàtica metastásica.](https://epos.myesr.org/posterimage/esr/seram2012/113626/media/448737?maxheight=150&maxwidth=150)