Con la introducción de las secuencias EPI para valorar el grado de movimiento del agua en el interior de los tejidos,
las secuencias potenciadas en difusión se han establecido dentro de los protocolos para el estudio de patología cerebral,
especialmente en la detección precoz de isquemia y en la caracterización tumoral basada en el grado de celularidad.
En la actualidad el uso de secuencias EPI-DWI se ha extendido para caracterización de lesiones fuera del cerebro y una de las regiones en las que más se ha avanzado en la aplicación de dicha técnica es el área ORL.
No obstante existen algunas dificultades técnicas derivadas del uso de esta técnica en cabeza y cuello,
especialmente artefactos por susceptibilidad debido a la presencia de implantes metálicos,
la interfaz aire-hueso-tejidos blandos y a los artefactos por movimientos secundarios a respiración,
deglución y pulsatilidad de los grandes troncos supaaórticos.
El uso de secuencias SS-EPI con adquisición de imagen paralela o mediante navegador pueden mejorar la calidad técnica de las imágenes.
El artefacto de Nyquist, caracterizado por la presencia de una imagen “fantasma” que ocupa la mitad del campo de visión en la dirección de codificación de fase puede ser reducido realizando una precalibración con el gradiente de codificación de fase apagado.
Las secuencias DWIBS (diffusion-weighted whole body imaging with background body-signal suppression) también pueden ser usadas en cabeza y cuello aunque son más susceptibles a sufrir una importante distorsión en el plano anteroposterior.
Además hay que tener en cuenta que los valores ADC obtenidos suelen ser menores que los derivados del uso de secuencias EPI-DWI convencionales.
Con el fin de reducir los artefactos por movimiento es importante no superar un tiempo de adquisición de la secuencia mayor a 5 minutos.
También pueden usarse secuencias que simplifican la adquisición del espacio k como SENSE o PROPELLER que ayudan a su vez a disminuir los artefactos por interfase aire-tejidos.
En nuestro centro normalmente usamos una secuencia SS-EPI con 5 valores b entre 0 y 1000 s/mm2.
La diferenciación entre verdadera difusión y perfusión puede llevarse a cabo mediante el uso del modelo bicompartimental IVIM,
usado con éxito en otras regiones anatómicas.
Según este modelo,
desarrollado por Le Bihan y colaboradores para valorar cuantitativamente el movimiento microscópico translacional que ocurre en cada voxel de la imagen.
Demostraron que se puede distinguir entre la difusión molecular pura y la microcirculación usando múltiples valores b por debajo y por encima de 200 s/mm2 obteniendo una caida de señal biexponencial.
La primera parte de la caída,
rápida, se debe a efecto de la difusión y perfusión (con valores menores de 100 s/mm2) y la difusión real (D) muestra una caída más lenta de la señal.
A partir de estos datos se puede estimar la difusión real (D) y la fracción de perfusión (f) parámetro que permite estimar el grado de neovascularización de la lesión sin necesidad de usar técnicas convencionales que requieren contraste intravenoso.
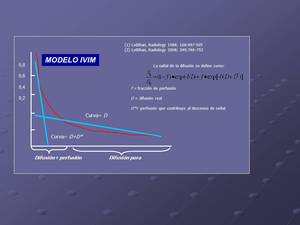
Fig. 1: Modelo IVIM
Caracterización de tumores benignos y malignos:
Las secuencias DWI se han mostrado prometedoras como herramienta para diferenciar lesiones benignas de malignas en el área ORL con puntos de corte de valores ADC propuestos entre 1,22 y 1,30 x 10-3 mm2/s.
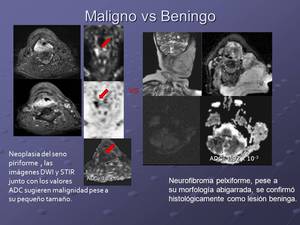
Fig. 4: Valores ADC en mm2/s
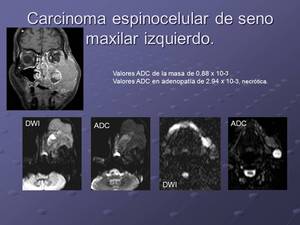
Fig. 10: Valores ADC en mm2/s
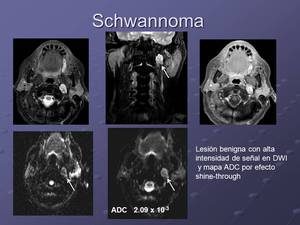
Fig. 15
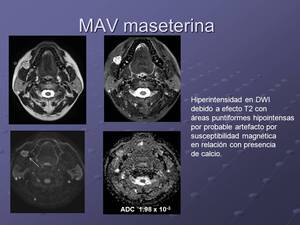
Fig. 16: Valores ADC en mm2/s
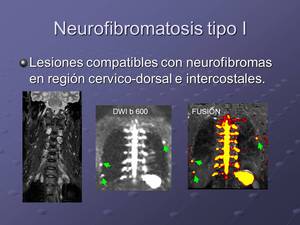
Fig. 19
Mediante los valores ADC también puede permitir la diferenciación entre afectación adenopática por carcinoma de células escamosas y linfoma,
ambas,
entidades frecuentes en la región cervical,
en donde los valores medios de ADC en el linfoma son significativamente menor que en el carcinoma de células escamosas,
hallazgos que se correlacionan con la hipercelularidad del citoplasma de las células linfoides.(Maeda M,
et al.
AJNR 2005; 26: 1186-1192)
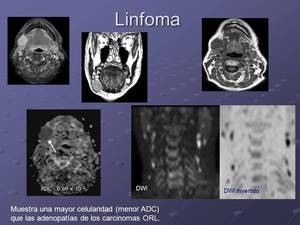
Fig. 13: Valores ADC en mm2/s
Al igual que ocurre con el uso de contraste exógeno y las técnicas de perfusión,
la difusión permite diferenciar áreas necróticas de viables en el interior de las lesiones tumorales o adenopatías,
dato que permite orientar la realización de biopsias para evitar falsos negativos.
El uso del modelo bicompartimental de difusión,
también permite estimar la perfusión tumoral sin necesidad de contraste.
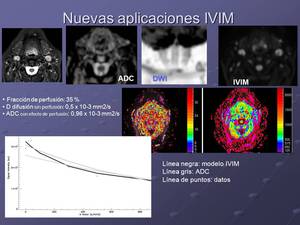
Fig. 5: Carcinoma del seno pirforme
La difusión permite realizar una adecuada estadificación tumoral en el área ORL ayudando a identificar invasión de estrcuturas vecinas y facilitando la detección de adenopatías patológicas en los distintos niveles ganglionares.
El uso de técnicas de fusión entre distintas secuencias con la difusión puede ayudar a obtener una adecuada correlación entre los hallazgos.
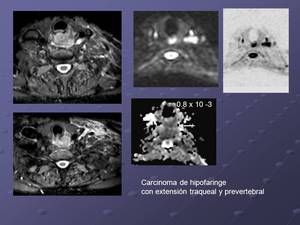
Fig. 2: Valores ADC en mmm2/s
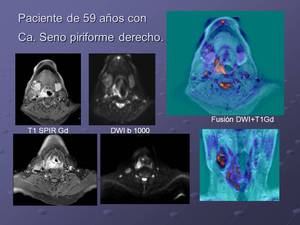
Fig. 3
La difusión también ha mostrado su utilidad en la caracterización de lesiones en glándulas salivares ayudando al diagnóstico diferencial clásico entre adenoma pleomorfo y tumor de Warthin mostrando el primero,
dada su heterogeneidad valores ADC más elevados que el tumor de Warthin.
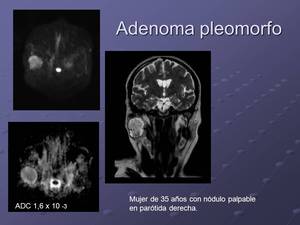
Fig. 17: Valores ADC en mm2/s
La patología infecciosa-inflamatoria de glándulas salivares también se ve beneficiada del uso de DWI permitiendo diferenciar áreas abscesificadas o necróticas de áreas flemonosas y valorando respuesta a tratamiento.
(Kakimoto et al.
Eur J Radiol 2006; extra 60: 11-14)
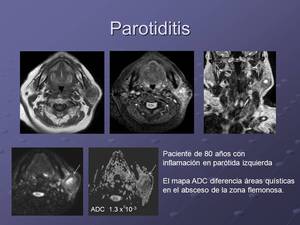
Fig. 18: Valores ADC en mm2/s
Monitorización y respuesta al tratamiento:
Hoy en día el tratamiento de la neoplasias en general y las de cabeza y cuello en particular se realiza de forma indivializada dependiendo de las características del tumor y del propio paciente.
Tumores primarios con valores ADC bajos se han relacionado con una adecuada respuesta a quimio y radioterapia,
de hecho,
el aumento en dichos valores en la primera semana tras el tratamiento se ha asociado a una adecuada respuesta y mayor posibilidad de remisión completa,
tanto en el tumor primario como en las adenopatías locorregionales.
La presencia de valores bajos de ADC parece correlacionarse con un menor grado de hipoxia tisular,
una de las principales causas de resistencia al tratamiento.
(Kim S, et al. Clin Cancer Re 2009; 15 (3):986-994)
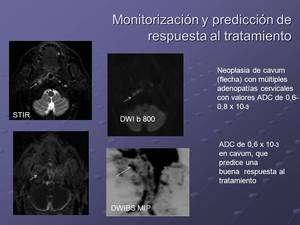
Fig. 6: Valores ADC en mm2/s
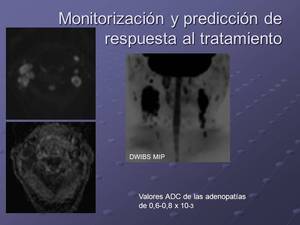
Fig. 7: Valores ADC en mm2/s
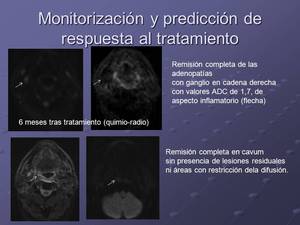
Fig. 8: Valores ADC en mm2/s
Detección de recurrencia:
El seguimiento tras el tratamiento es fundamental en este tipo de pacientes,
especialmente tras la radioterapia.
La existencia de edema,
fibrosis y reacción inflamatoria entorno a la cicatriz posquirúrgica dificulta en numerosas ocasiones la reevaluación y despistaje de recidiva con las secuencias convencionales,
incluso con el uso de contraste.
(Vandercaveye V,et al.
Int J Radiat Oncol Biol Phys 2007; 67:960-971)
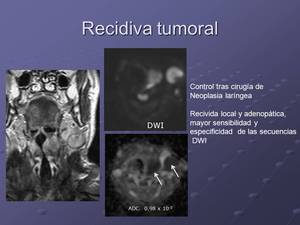
Fig. 11: Valores ADC en mm2/s
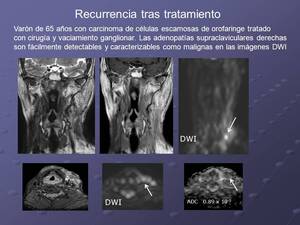
Fig. 9: Valores ADC en mm2/s
Para ello se ha usado el PET-CT con FDG,
que mejora la sensibilidad para la detección de recidiva frente al CT o MRI convencional,
no obstante pueden existir falsos positivos debido a la presencia de cambios inflamatorios.
Las secuencias potenciadas en difusión pueden ayudar a mejorar la sensibilidad y especificidad para la detección de recidiva ya que permiten eliminar el efecto tanto del edema como de la reacción fibrosa-inflamatoria.
Además permiten incrementar la detección de la carga lesional en lo que respecta a afectación adenopática que mediante secuencias morfológicas convencionales pudiera pasar desapercibida.
También es útil para detectar recurrencia o metástasis en localizaciones poco habituales.
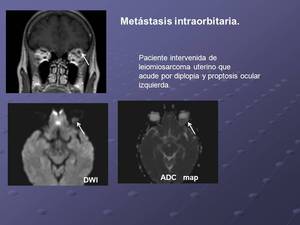
Fig. 14
Evaluación de adenopatías cervicales:
El estadiaje de las neoplasias de cabeza y cuello es fundamental para su manejo terapéutico.
Los valores ADC de las adenopatías metastásicas son significativamente inferiores a los de los ganglios benignos,
llegando a proponerse 0.9 x 10-3 mm2/s como valor de ADC para discriminar entre ambas entidades.
Según otros autores,
las adenopatías de carácter inflamatorio mostrarían valores ADC por encima de 1,7 x 10-3 mm2/s.
Adenopatías de tamaño aparentemente normal (incluso hasta5 mm) que en principio no cumplirían criterios de malignidad pueden ser catalogadas como patológicas en función de los valores ADC.
Es de gran importancia tener cuidado a la hora de calcular los valores de ADC,
ya que en el caso de las adenopatías metastásicas con componente necrótico,
éste puede hacer que el valor de ADC sea más alto de lo esperado.
De forma similar hay que tener cuidado con la inclusión del hilio graso en la medida del ADC ya que la DWI,
al ser una secuencia con supresión grasa,
la disminución de señal a nivel del hilio puede arrojar valores ADC menores de los reales e interpretarlo como falso positivo.
Como hemos comentado anteriormente,
el uso de secuencias DWI permite detectar un mayor número de adenopatías patológicas que otras técnicas convencionales.
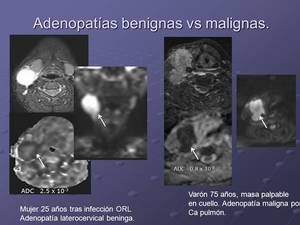
Fig. 12: Valores ADC en mm2/s
Si combinamos criterios morfológicos clásicos como el tamaño,
morfología,
contornos,
grado de homogeneidad en secuencias T2 con supresión grasa y preservación de hilio vascular con valores ADC,
la caracterización de dichas adenopatías mejora de forma considerable.





















