Las integrinas son un grupo de receptores heterodímeros de superficie celular relacionados,
entre otros,
con los fenómenos de angiogénesis y los procesos de adhesión celular al estroma intercelular,
y que además se sobre-expresan en algunos tipos de tumores sólidos.
Las integrinas poseen dos subunidades alfa y beta que combinadas conforman 24 tipos de receptores diferentes.
Las integrinas αVβ3,
αVβ5 y αVβ1 se encuentran especialmente relacionadas con la angiogénesis y las metástasis de las neoplasias sólidas.
Los péptidos RGD (arginina-glicina-ácido aspártico) han demostrado su afinidad por las integrinas,
lo cual establece su posible utilidad como agentes transportadores de sustancias hacia regiones del organismo con actividad angiogénica intensa,
o con determinadas estirpes neoplásicas en desarrollo.
En este contexto,
un RGD cíclico conocido como Cilengitide,
ha mostrado un efecto antiangiogénico al bloquear las integrinas αVβ3,
αVβ5 y αVβ1,
y en la actualidad se encuentra en estudios clínicos para evaluar su potencial efecto antitumoral en el tratamiento del glioblastoma y otros tumores sólidos.
En algunos de estos estudios,
la pauta de administración del Cilengitide consistía en la infusión intravenosas de entre 120 y 2400 mg/m2 del fármaco,
dos veces por semana,
durante cuatro semanas.
En general,
en los fármacos antitumorales el cálculo de dosis para un individuo se realiza en función de la BSA (Body Surface Area) y son valores que se obtienen en g ó mg / m2.
Existen varias fórmulas para calcular la BSA y una utilizada es la de Mosteller: BSA en m2 = ( Altura en cm x Peso en kg / 3600 ) ½.
Una vez obtenido la BSA,
este valor se correlaciona con la pauta de administración recomendada para el fármaco concreto y así se calcula la cantidad de producto que debe administrarse a un individuo.
En el caso de los estudios con Cilengitide,
es llamativo el amplio rango de dosis utilizado en las diferentes pautas terapéuticas.
La razón a esta amplia variación en las dosis empleadas se encuentra en la búsqueda y determinación del adecuado balance entre un mejor efecto terapéutico y una menor toxicidad.
Nosotros hemos sintetizado peptidomiméticos RGD con alta afinidad por las integrinas αVβ3,
susceptibles de ser conjugados también con otros tipos de sustancias,
y que podrían también tener actividad antiangiogénica.
Concretamente,
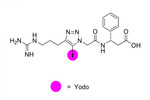
hemos diseñado un peptidomimético RGD lineal portador de un átomo de yodo en su cadena (Fig.1),
que en modelización informática ha mostrado alta afinidad por las integrinas αVβ3.
Nuestro objetivo se centra en desarrollar un peptidomimético yodado (RGD-I) que al unirse a las integrinas αVβ3,
ponga en evidencia en estudios de TCMC,
las lesiones tumorales en las que se deposite.
Dado que este RGD-I bloquearía las integrinas,
mostraría también un efecto antitumoral y podría ser considerado como agente teranóstico.
Como primer paso para el estudio de las propiedades de esta molécula,
hemos desarrollado un estudio piloto experimental en animales de laboratorio.
Procedimiento Experimental
1.
Objetivo.
Comprobar la afinidad de un peptidomimético RGD-I por los receptores αVβ3 presentes en las células endoteliales y tumorales de implantes hepáticos de adenocarcinoma de colon (CC-531),
así como valorar su capacidad para bloquear estos receptores y alterar la biología de las lesiones tumorales.
2.
Material y métodos.
A.
Peptidomiméticos y pautas de administración:
El RGD-I es una molécula que en medio orgánico muestra una alta tendencia a la auto-agregación.
Para favorecer su solubilidad en medio acuoso y disminuir su agregación fue preciso obtener diluciones en medio ácido,
motivo por el cual se prepararon las suspensiones de RGD-I en L-Lactato.
Estas suspensiones serían posteriormente inyectadas por vía intraperitoneal (ip) en animales de laboratorio.
Se diseñaron dos pautas de tratamiento diferentes con una duración de tres semanas,
en las que los peptidomiméticos se administraron dos veces por semana (6 dosis),
o a intervalos de 48h (10 dosis).
Para la primera pauta de infusión se preparó una solución de 7,2mg de L-Lactato + 4mg de RGD-I,
y para la segunda una solución de 9,48mg de L-Lactato + 6mg de RGD-I.
La cantidad de RGD-I que se administró,
extrapolada a los valores empleados de Cilengitide en humanos,
vendría a corresponderse con cifras de 650 - 1000 mg/m2,
es decir unas dosis de rango intermedio.
B.
Animales:
El experimento se desarrolló en 49 ratas macho WagRijCrl de 3 meses de edad,
y con un peso promedio de 260g.
Los animales se distribuyeron en varios grupos para evaluar los tumores según las diferentes pautas de tratamiento.
Fue preciso estudiar también los posibles efectos derivados de la infusión del L-Lactato.
Todos los procedimientos se practicaron de acuerdo a la legislación vigente sobre experimentación animal dictada por el Gobierno de España (Real Decreto 1201/2005,
de 10 de octubre).
C.
Inducción Tumoral:
En el día 0 del proceso experimental a los animales se les practicaba una laparotomía media subxifoidea para exponer el hígado.
Posteriormente se realizaba punción subcapsular directa en el lóbulo hepático izquierdo,
para inyectar 25.000 células singénicas de adenocarcinoma de colon (línea celular: CC-531) suspendidas en 0,05ml de solución de Hank.
En el proceso de inoculación tumoral,
los animales se mantuvieron bajo anestesia inhalada inducida por Halotano.
D.
Control del desarrollo tumoral:
Para monitorizar el desarrollo y progresión de las lesiones neoplásicas hepáticas,
a los animales se les realizaron ecografías abdominales seriadas.
Las ecografías se practicaron en un ecógrafo “MyLab60 XVision” de Esaote,
dotado con una sonda lineal multi-frecuencia de 6-18 Mhz.
Como paso previo a la ecografía fue necesario depilar la mitad superior del abdomen de las ratas mediante la aplicación de una crema depilatoria estándar.
Los estudios requirieron de anestesia inhalada inducida por Halotano.
A los 15 días tras la inoculación se realizaba una ecografía de control de inducción tumoral (US.0).
En este procedimiento se trataba de determinar la presencia de alteraciones en la ecoestructura del lóbulo hepático izquierdo,
en relación a cambios reactivos a la punción de células tumorales e indicativos de una mayor probabilidad de evolucionar a implantes tumorales.
En las US.0,
la observación de un foco hipoecoico con cierto efecto de masa en el lóbulo inoculado se consideró implante tumoral probable (+),
y la ausencia de hallazgos se consideró implante tumoral no inducido (-).
Tras 21,
28 y 35 días de la inoculación tumoral se realizaron ecografías (US.1,
US.2 y US.3) para valorar el volumen de los implantes tumorales observados en los hígados de los animales.
Como signos ecográficos de desarrollo neoplásico se consideró la observación de nódulos intrahepáticos de ecoestructura diferente y distinguible del parénquima circundante (nódulos en general hiperecoicos),
asociados o no a abombamientos focales en la superficie de la víscera.
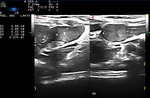
Para determinar el volumen tumoral en ml,
se empleó la fórmula modificada de un elipsoide: π/6 x (AxBxC).
Donde A,
B y C son los tres diámetros mayores en proyección axial,
sagital y coronal,
medidos en centímetros (Fig.2 y Fig.3).
Los implantes tumorales que en US.3 presentaban un volumen < 0,06 ml se consideraron implantes no viables.
Estos tumores que no habían conseguido dotarse de un sistema vascular adecuado,
no se incluyeron en los análisis estadísticos.
E.
Grupos experimentales y pautas terapéuticas:
Los 49 animales fueron distribuidos en los grupos experimentales que se describen a continuación:
- Grupo Control,
n=13,
animales en los que se valoraron las características de los implantes tumorales dejados a una evolución natural.
- Grupo Lac-1,
n=10,
animales infundidos con 6 dosis ip (cadencia 4/3 días) de 7,2mg de L-Lactato.
- Grupo RGD-1,
n=10,
animales infundidos con 6 dosis ip (cadencia 4/3 días) de 7,2mg de L-Lactato + 4mg de RGD-I.
- Grupo Lac-2,
n=9,
animales infundidos con 10 dosis ip (cadencia 48h) de 9,48mg de L-Lactato.
- Grupo RGD-2,
n=7,
animales infundidos con 10 dosis ip (cadencia 48h) de 9,48mg de L-Lactato + 6mg de RGD-I.
Las infusiones de las diferentes suspensiones se iniciaron a los 15 días de la inducción tumoral,
salvo en el grupo Control que no recibió ningún tipo de infusión.
El día 33 de los experimentos se realizaba la última infusión.
A los 35 días todos los animales eran sacrificados.
F.
Obtención de muestras para realización de TCMC y para estudio histológico:
A todos los animales se les extraía el hígado y se verificaban los datos obtenidos en los estudios ecográficos en lo referente a presencia o no de implantes.
De este modo se establecía el rendimiento tumoral de la serie,
es decir,
el porcentaje de animales que habían desarrollado lesiones con volumen > 0.06 ml a los 35 días de la inoculación.
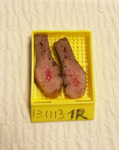
Los lóbulos hepáticos izquierdos,
portadores de las lesiones tumorales,
eran introducidos en placas de plástico individuales para ser fijados en formol,
y posteriormente ser procesados (Fig.4).
Tras 48 horas de inmersión en formol,
las placas con las muestras histológicas de los animales de los grupos Lac-2 y RGD-2,
fueron estudiados en un equipo de TC Toshiba "Aquilion" de 64 detectores.
En las series de TCMC se determinaron los valores de atenuación en unidades Hounsfield (UH) de los tejidos hepático y tumoral,
y los valores obtenidos serían posteriormente contrastados con los determinados en experimentos anteriormente realizados por nuestro grupo.
A este respecto,
en estudios previos de TCMC practicados en 12 ratas vivas,
se midieron los valores de atenuación del hígado y de las lesiones tumorales:
- Hígado: Md = 92 (rango= 82-99) UH.
- Tumor: Md = 55 (rango= 36-65) UH.
Por otro lado,
también en estudios previos realizados en seis muestras hepáticas con implantes tumorales y fijadas en formol,
se habían determinado los valores de atenuación de los tejidos (Fig.5):
- Hígado: Md = 116 (rango= 99-145) UH.
- Tumor: Md = 95 (rango= 82-107) UH.
De lo observado en estos estudios se deducía que el procesado en formol,
al disminuir la cantidad tisular de agua,
provocaba el incremento de los valores de atenuación en el tejido fijado.
Este efecto se hacía más evidente en el tejido tumoral,
dada su mayor proporción de agua.
Tras ser fijadas en formol,
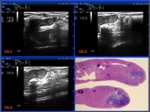
las lesiones tumorales metastásicas se incluyeron en su totalidad para su estudio histológico con tinción de hematoxilina-eosina.
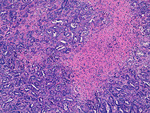
De todas ellas se realizó una estimación del porcentaje de necrosis tumoral mediante una evaluación morfológica por microscopía óptica de todas las secciones (Fig.6).
G.
Estudio estadístico:
Las variables cuantitativas volumen tumoral y coeficiente de atenuación se han descrito mediante los valores de la media y la desviación estándar o por la mediana (Md) y el rango.
La variable necrosis tumoral se ha descrito por su porcentaje.
Se han realizado análisis comparativos entre los volúmenes tumorales de los cinco grupos de animales,
determinados en US.1,
US.2 y US.3,
y de los porcentajes de necrosis determinados en histología,
mediante el test no paramétrico de Kruskal-Wallis.
Se consideraron significativos valores de p<0,05.
La representación gráfica de los valores determinados se ha plasmado en diagramas de barras.
Se ha analizado la posible relación lineal entre las variables volumen tumoral en US.3 y porcentaje de necrosis tumoral.
Se han realizado gráficos de dispersión simples y se ha calculado el coeficiente de correlación lineal de Pearson (r),
la recta de regresión lineal y el coeficiente de determinación (R2).
3.
Resultados.
En ninguno de los grupos evaluados se constataron muertes de animales.
Los resultados de la evaluación ecográfica sugestivos de implante tumoral probable (+) o no inducido (-) realizada en US.0,
de la cuantificación del volumen tumoral en las ecografías seriadas,
de la presencia o no de implantes viables en las muestras histológicas y del porcentaje de necrosis tumoral,
se exponen en las diferentes tablas.
A.
Grupo Control:
En ocho animales se constató desarrollo tumoral pero sólo en seis se consideró adecuado.
El rendimiento tumoral de la serie Control,
es decir,
el porcentaje de animales que desarrollaron lesiones con volumen > 0.06 ml a los 35 días de la inoculación,
fue del 46%.
El porcentaje de tumores no viables fue del 15%.
No hubo desarrollo tumoral en el 38%.
(Fig.7: Tabla).
B.
Grupo Lac-1:
Cinco animales desarrollaron tumores adecuadamente.
El rendimiento tumoral de la serie Lac-1 fue del 50%.
El porcentaje de tumores no viables fue del 30%.
No hubo desarrollo tumoral en el 20%.
(Fig.8: Tabla).
C.
Grupo RGD-1:
Seis animales mostraron desarrollo tumoral óptimo.
El rendimiento tumoral de la serie Lac-1 fue del 60%.
El porcentaje de tumores no viables fue del 10%.
No hubo desarrollo tumoral en el 30%.
(Fig.9: Tabla).
D.
Grupo Lac-2:
Seis animales desarrollaron implantes adecuados. El rendimiento tumoral de la serie Lac-2 fue del 66%.
El porcentaje de tumores no viables fue del 0%.
No hubo desarrollo tumoral en el 34%.
(Fig.10: Tabla).
En lo referente a las medidas practicadas en TCMC,
los valores de atenuación medidos en los tejidos fueron:
- Hígado: Md = 115 (rango= 92-131) UH.
- Tumor: Md = 93 (rango= 81-112) UH.
E.
Grupo RGD-2:
Seis animales mostraron desarrollo tumoral óptimo.
El rendimiento tumoral de la serie Lac-1 fue del 85%.
El porcentaje de tumores no viables fue del 0%.
No hubo desarrollo tumoral en el 15%.
(Fig.11: Tabla).
En lo referente a las medidas practicadas en TCMC,
los valores de atenuación determinados en los tejidos fueron:
- Hígado: Md = 98 (rango= 91-115) UH.
- Tumor: Md = 87 (rango= 79-92) UH.
F.
Análisis estadístico:
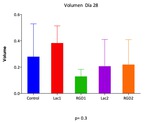
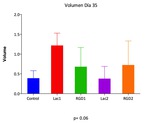
Cuando se realizó el análisis comparativo mediante el test no paramétrico de Kruskal-Wallis de los volúmenes tumorales determinados en US.1,
U.S.2 y U.S.3,
de las cinco series experimentales,
se comprobó ausencia de diferencias significativas entre los diferentes grupos de animales.
Los valores de p a los 21,
28 y 35 días,
fueron respectivamente: p=0.25,
p=0.3 y p=0.06 (Fig.12,
Fig.13 y Fig.14).
El test de Kruskal-Wallis aplicado a los valores de necrosis determinados en los cinco grupos experimentales,
evidenció diferencias significativas entre el grupo Lac-1 y los grupos Control y Lac-2.
G.
Correlación entre volumen tumoral y necrosis:
Dado que no se observaron diferencias significativas en el volumen tumoral de los grupos de animales,
se confeccionó una gráfica de dispersión considerando conjuntamente los valores de volumen tumoral en US.3 y el porcentaje de necrosis estimado en el estudio histológico.
En la dispersión simple se comprobó que existía una relación lineal.
Al analizar los datos,
se obtuvo un coeficiente de correlación de Pearson,
r= 0.686,
moderadamente elevado,
y además significativo.
El valor del coeficiente de determinación fue: R2= 0.47.
(Fig.15).