1.
PRIMEROS CRITERIOS DE RESPUESTA
Los criterios que se utilizan para valorar la respuesta al tratamiento oncológico por imagen han ido variando a lo largo de las tres últimas décadas.
Los primeros fueron los criterios creados por la Organización Mundial de la Salud (OMS),
publicados en 1981,
que establecían unos parámetros uniformes y estandarizados para registrar la respuesta al tratamiento oncológico,
la recurrencia y el intervalo libre de enfermedad.
Se basaba en una medida bidimensional,
y no establecía un tamaño mínimo de las lesiones ni el número de lesiones que debían ser seleccionadas para el seguimiento (lesiones diana).
En el año 2000,
se publicaron los criterios RECIST (Response Evaluation Criteria in Solid Tumors),
llamados posteriormente criterios RECIST 1.0,
ya que se revisaron en 2009 (criterios RECIST 1.1).
Estos criterios surgieron como modificación de los anteriores criterios de respuesta,
estableciendo la definición de lesiones medibles y no medibles,
de lesiones diana y no diana (utilizando siempre una medida unidimensional) y modificaron los criterios de respuesta al tratamiento.
Las principales diferencias entre los criterios de la OMS,
los RECIST 1.0 y los RECIST 1.1 se resumen en la ( Table 1 ).
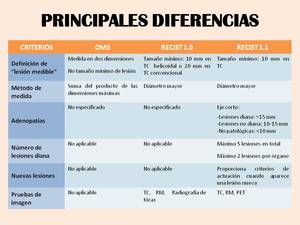
Table 1: Principales diferencias entre los criterios de la OMS, los RECIST 1.0 y los RECIST 1.1
2.
CRITERIOS RECIST 1.1
Surgen como revisión de los anteriores criterios RECIST por parte de un grupo multidisciplinar,
que lleva a cabo un estudio prospectivo entre 1993 y 2005,
con más de 6500 pacientes y 18000 lesiones diana.
En la actualidad son los criterios que se utilizan en el seguimiento del tratamiento de la mayor parte de tumores sólidos.
2.1.
Lesiones medibles / no medibles:
Generalmente las mediciones se realizarán en el plano axial de la TC,
salvo algunos tumores como los paraespinales que deben ser medidos en las reconstrucciones sagitales o coronales.
Para ser consideradas lesiones medibles (en un espesor de corte de TC de hasta 5 mm),
éstas deben medir al menos 10 mm de diámetro máximo,
y las adenopatías,
al menos 15 mm de eje corto (el eje corto se recomienda por ser más reproducible y mejor predictor de la afectación metastásica).
Las metástasis quísticas y las metástasis óseas líticas o mixtas con claro componente de partes blandas,
son consideradas también lesiones medibles si cumplen el criterio de 10 mm de diámetro mayor,
al que nos hemos referido anteriormente.
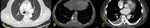
Fig. 1
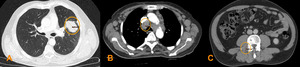
Fig. 1: Ejemplos de lesiones medibles:
A: Neoplasia pulmonar en LII (medida en su diámetro mayor),
B: Adenopatía paratraqueal derecha (medida en su eje corto),
C: Metástasis ósea lítica con componente de partes blandas (medida en su diámetro mayor).
Dentro de las lesiones no medibles se engloban: lesiones con diámetro máximo inferior a 10 mm,
adenopatías con eje corto inferior a 10-15 mm (las inferiores a 10 mm se consideran normales),
metástasis óseas blásticas,
lesiones quísticas indeterminadas o complejas (los quistes simples no entran dentro de la división entre medibles y no medibles),
ascitis,
derrame pleural y pericárdico,
enfermedad leptomeníngea,
enfermedad inflamatoria de la mama,
linfangitis carcinomatosa cutánea o pulmonar,
lesiones en áreas previamente irradiadas (excepto si hay un cambio en el tamaño de la lesión).
Fig. 2
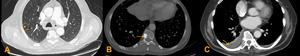
Fig. 2: Ejemplos de lesiones no medibles:
A: Metástasis pulmonar inferior a 10 mm,
B: Metástasis ósea blástica,
C: Derrame pleural.
2.2.
Lesiones diana / no diana:
Las lesiones diana son aquellas lesiones medibles que se eligen para el seguimiento del paciente oncológico a partir del estudio de basal.
Deben ser las lesiones más representativas de la enfermedad y es recomendable evitar las localizadas en órganos móviles como ovarios o tracto gastrointestinal.
Serán un máximo de dos lesiones por órgano y hasta cinco lesiones en total,
y se utilizará la suma de sus diámetros máximos para evaluar la respuesta al tratamiento en los controles posteriores.
No siempre son las de mayor tamaño,
sino que deben ser lesiones bien definidas y reproducibles,
para poder realizar un correcto seguimiento de las mismas.
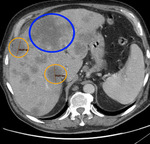
Fig. 3
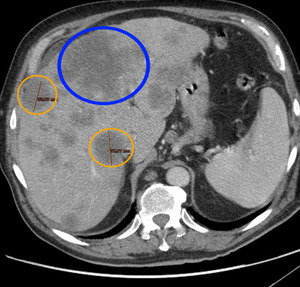
Fig. 3: Elección de las lesiones diana: la lesión de mayor tamaño (círculo azul) presenta una morfología irregular, siendo menos reproducible en controles sucesivos, por lo que las dos siguientes lesiones hepáticas de mayor tamaño (círculos naranjas) serán las utilizadas como lesiones diana (máximo dos por órgano).
Se deben medir siempre en su diámetro mayor,
incluso cuando el corte y la orientación sean diferentes del que presentaba la lesión diana en el estudio basal.
Si una lesión diana se separa,
se debe medir el diámetro mayor de cada lesión por separado para calcular la suma de las lesiones diana.
Cuando las lesiones se han unido y no son divisibles,el diámetro mayor será el de la lesión fusionada.
Si las lesiones presentan un realce en anillo,
éste debe ser incluido en el diámetro mayor medido.
También debemos seguir realizando la medida del diámetro mayor cuando las lesiones presentan cavitación o necrosis central.
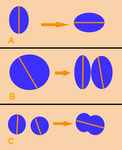
Fig. 4
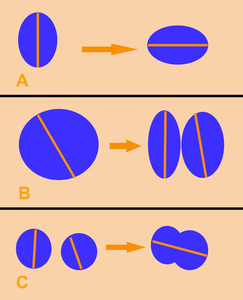
Fig. 4: Formas de medir las lesiones diana:
A: Si cambia de orientación, medir el nuevo diámetro mayor.
B: Si la lesión se divide en dos, medir el diámetro mayor de cada una de las dos nuevas lesiones.
C: Si dos lesiones diana se fusionan, medir el diámetro mayor de la lesión fusionada.
El resto de lesiones medibles y no medibles se denominarán lesiones no diana,
que deben ser registradas en nuestro informe inicial (por ejemplo,
como múltiples metástasis pulmonares) y no requieren ser medidas en cada evaluación,
pero sí informar de sus modificaciones.
Un ligero crecimiento en estas lesiones no diana no justifica la progresión de la enfermedad,
sino que deben presentar un crecimiento evidente para tenerlas en cuenta.
Fig. 5
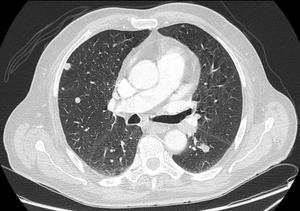
Fig. 5: Ejemplo de lesiones no diana: Múltiples metástasis pulmonares de pequeño tamaño.
2.3.
Evaluación del estudio basal:
Para evaluar objetivamente la respuesta al tratamiento oncológico,
es necesario estimar la carga tumoral global en el estudio basal para poder realizar después las comparaciones posteriores al inicio del tratamiento.
Este estudio basal debe realizarse al menos cuatro semanas antes de iniciar el tratamiento con quimioterapia.
Todas las lesiones representativas de los órganos afectados deben ser identificadas como lesiones diana.
La suma de los diámetros de todas las lesiones diana debe ser calculada y documentada.
Esta suma es la que se utilizará para el seguimiento y valoración objetiva de la respuesta tumoral.
2.4.
Criterios de respuesta al tratamiento:
Generalmente se realizarán controles sucesivos cada 6-8 semanas,
coincidiendo con el final de cada ciclo de tratamiento.
La evaluación se realizará en base a las lesiones diana (de forma cuantitativa) y a las lesiones no diana (de manera cualitativa).
Se dividirá en diferentes categorías en base a la respuesta al tratamiento: respuesta completa (RC),
respuesta parcial (RP),
progresión de la enfermedad (PE) o enfermedad estable (EE).
Table 2

Table 2: Criterios RECIST para evaluar la respuesta al tratamiento. (RC: Respuesta completa; RP: Respuesta parcial; PE: Progresión de la enfermedad; EE: Enfermedad estable)
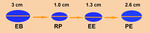
Fig. 6
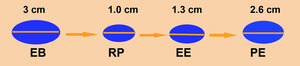
Fig. 6: Ejemplo de evaluación de la respuesta al tratamiento en una lesión diana. (EB: Estudio basal; RP: Respuesta parcial; EE: Enfermedad estable; PE: Progresión de la enfermedad).
Cuando una lesión diana es demasiado pequeña para ser medida,
se dará por defecto un diámetro de 5 mm,
salvo si se cree que prácticamente ha desaparecido,
que se le puede dar un diámetro de 0 mm.
El hallazgo de una nueva lesión debe ser inequívoco,
es decir,
no atribuible a diferencias en la técnica de imagen,
cambio en el tipo de prueba de imagen o hallazgos que se crea que se deben a algo diferente al tumor.
Esto es particularmente importante cuando las lesiones del estudio basal presentan RC o RP.
En caso de duda,
realizar una evaluación de dicha lesión en los estudios posteriores.
Si se visualiza una lesión en una región anatómica no valorada con anterioridad,
se considerará nueva lesión e indicará PE.
La evaluación de la respuesta global (RG) se realiza teniendo en cuenta los cambios en las lesiones diana y en las lesiones no diana,
así como la presencia o ausencia de nuevas lesiones.
La mejor RG es la mejor respuesta obtenida desde el inicio hasta el final del tratamiento.
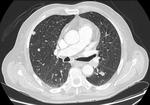
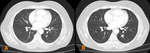
Fig. 7
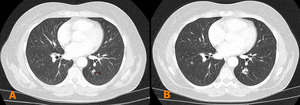
Fig. 7: Ejemplo de progresión de la enfermedad.
El paciente presentaba un tumor de recto con múltiples metástasis pulmonares, con aumento del tamaño de la lesión diana mayor del 20% desde un control anterior (A) al control siguiente a las 8 semanas del tratamiento (B).
3.
OTROS CRITERIOS DE RESPUESTA
La aparición de nuevos tratamientos oncológicos diferentes a las terapias citotóxicas clásicas que producen otros tipos de respuesta diferente a la disminución del tamaño de la lesión evaluada en los criterios RECIST (disminución de la vascularización de la lesión,
cavitación central,
cambios quísticos o hemorragia central con/sin variación del tamaño de la lesión) hace que surja la necesidad de crear otros criterios que permitan evaluar la respuesta a dichos tratamientos.
De entre los numerosos criterios existentes (y los que presumiblemente aparecerán en los próximos años),
nombraremos algunos de los más utilizados actualmente.
3.1.
Criterios Choi:
Son los criterios utilizados en la evaluación del tratamiento con imatinib de los tumores del estroma gastrointestinal (GIST).
En este caso lo más característico es que disminuye la densidad de las lesiones por degeneración mixoide,
hemorragia o necrosis.
Estos criterios,
basados en el estudio por TC,
incluyen el tamaño tumoral,
su densidad y la aparición de nódulos hipervasculares intratumorales.
Presentan una alta correlación entre los resultados obtenidos en TC y PET.
Table 3 Fig. 8
La TC debe realizarse en fases arterial (para ver los cambios en la vascularización y en la captación) y portal (para medir la densidad del tumor).
La PET será útil en pacientes tratados con imatinib que además presenten resección quirúrgica incompleta,
recidiva o metástasis y cuyos resultados en TC no sean concluyentes.
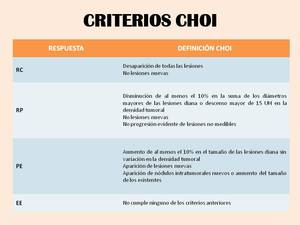
Table 3: Criterios Choi para evaluar la respuesta al tratamiento de los GIST. (RC: Respuesta completa; RP: Respuesta parcial; PE: Progresión de la enfermedad; EE: Enfermedad estable)
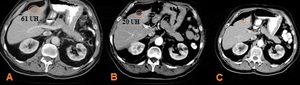
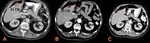
Fig. 8: Control mediante criterios Choi de metástasis hepática de un GIST.
El primer estudio previo al tratamiento (A) muestra una lesión de 61 UH, que en el primer control postratamiento (B) muestra una reducción de su densidad a 20 UH, que indica respuesta parcial, y en el siguiente control (C) se reduce hasta hacerse prácticamente invisible, considerándose respuesta completa.
3.2.
Criterios de respuesta en el hepatocarcinoma (HCC):
El uso del tamaño tumoral como única medida de evaluación de la respuesta al tratamiento puede ser erróneo cuando se utilizan fármacos como el sorafenib o terapias locorregionales,
ya que hay que tener en cuenta otras respuestas como la ausencia de realce de las lesiones o la necrosis tumoral inducida por el tratamiento.
Table 4
-Criterios RECIST modificados (mRECIST):
Se trata de una modificación de los criterios RECIST originales,
manteniendo la esencia de dichos criterios,
pero las lesiones diana deben presentar un claro realce en la fase arterial en el estudio dinámico por TC o RM y la evaluación de la respuesta se hará en base a la presencia o ausencia de dicho realce en los diferentes estudios de control.
La trombosis venosa portal maligna,
las adenopatías periportales menores de 20 mm de eje corto,
el derrame pleural y la ascitis se considerarán como lesiones no medibles.
-Criterios RECICL (Response Evaluation Criteria in Cancer of the Liver):
Se basa en el efecto necrótico del tratamiento sobre la lesión para valorar la respuesta.
Utiliza la suma de todas las lesiones diana medidas (máximo de 5) en dos dimensiones,
incluye la evaluación de marcadores y un protocolo para valorar el tratamiento locorregional como la ablación.

Table 4: Criterios mRECIST y RECICL para evaluar la respuesta al tratamiento de los hepatocarcinomas. (RC: Respuesta completa; RP: Respuesta parcial; PE: Progresión de la enfermedad; EE: Enfermedad estable)
3.3.
Criterios PERCIST (Positron Emission Tomography Response Criteria In Solid Tumors):
El estudio mediante PET es útil en los tumores tratados con fármacos citostáticos que disminuyen de manera más significativa el metabolismo del tumor que su tamaño.
La evaluación cuantitativa estandarizada de respuesta metabólica del tumor con PET requiere una medición consistente y fiable de la actividad tumoral,
por lo que se necesita que la técnica y el escáner entre el estudio basal y los de seguimiento sean los mismos,
utilizando dosis comparables de fluorodesoxiglucosa (FDG) y similares tiempos de absorción.
Se recomienda usar SUL (valor estandarizado de captación normalizado por masa magra corporal) para evaluar la respuesta al tratamiento,
que se realizará midiendo el porcentaje de cambio en el pico SUL en la lesión más activa en cada periodo de tiempo entre los estudios PET-TC pre y postratamiento.
Table 5
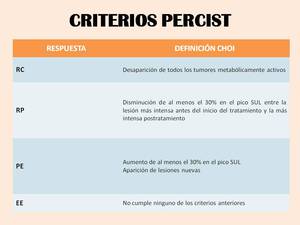
Table 5: Criterios PERCIST para evaluar la respuesta al tratamiento. (RC: Respuesta completa; RP: Respuesta parcial; PE: Progresión de la enfermedad; EE: Enfermedad estable)
3.4.
Criterios Cheson:
Los linfomas no suelen regresar por completo tras un tratamiento efectivo por fibrosis residual y restos necróticos,
por lo que la valoración única de su tamaño tiende a infravalorar la respuesta.
Estos criterios analizan tanto el tamaño como la actividad metabólica de los linfomas durante el curso del tratamiento mediante PET o PET-TC.
Se analizarán un máximo de seis nódulos o masas dominantes.
La presencia de una masa residual después del tratamiento que no ha desaparecido o no ha disminuido se considerará RC si la PET es negativa.
Table 6
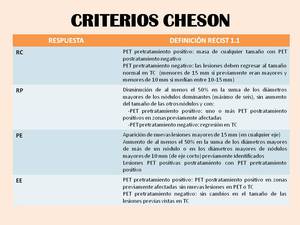
Table 6: Criterios Cheson para evaluar la respuesta al tratamiento de los linfomas. (RC: Respuesta completa; RP: Respuesta parcial; PE: Progresión de la enfermedad; EE: Enfermedad estable)
3.5.
Criterios MASS (Morphology,
Attenuation,
Size and Structure):
Estos criterios fueron creados como actualización de los antiguos criterios SACT (Size and Attenuation CT) para la evaluación de las terapias antiangiogénicas dirigidas al tratamiento de los tumores renales metastáticos.
Se aplican en estudio de TC con contraste intravenoso en fase venosa y se basa en la evaluación de la morfología,
la atenuación y la estructura de las lesiones diana.
La presencia de una necrosis central intensa (mayor del 50%),
una disminución en la densidad mayor de 40 HU y una disminución en el tamaño de las lesiones diana mayor del 20% (medido como en los criterios RECIST como la suma de los diámetros mayores de las lesiones diana) tras el primer ciclo de tratamiento indican buena supervivencia.
Table 7

Table 7: Criterios MASS para evaluar la respuesta al tratamiento de los tumores renales metastásicos