1-TECNICA Y PROTOCOLO DE ESTUDIO
Revisamos los hallazgos de RMC de pacientes con cardiopatía isquémica.
Incluimos además un grupo homogéneo de pacientes con IAM y reperfusión miocárdica,
evaluados en nuestro centro desde 2010 a 2012 (37 pacientes),
para evaluar el daño post-reperfusión.
La RMC inicial se les realizó a los 3-7 días post-infarto y RMC de seguimiento al mes y/o 6 meses y 12 meses.
Se utilizó un equipo de RM de 1.5-T (Achieva,
Philips Medical Systems,
Best,
The Netherlands).
Empleamos una antena de superficie phased-array de 12 elementos de cardio.
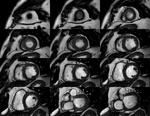
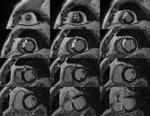
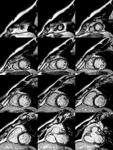
Función y volúmenes del ventrículo izquierdo (VI): Utilizamos secuencias de precesión libre en el estado estacionario,
(T2-Balanced TFE),
multicorte multifase en eje corto (EC) y secuencias de corte único multifase en planos cuatro,
dos y tres cámaras (4C,
2C,
3C).
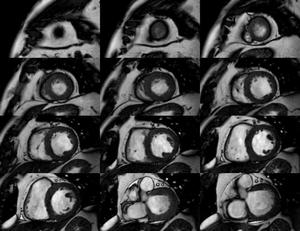
Fig. 1: Imagen cine T2-Balanced TFE , multicorte multifase en plano EC desde el ápex a la base.
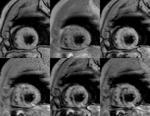
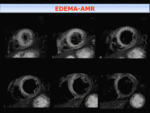
Edema-area en riesgo: se valora mediante secuencia de doble inversión-recuperación (IR) potenciadas en T2,
con saturación grasa, en eje corto,
cubriendo todo el ventrículo,
y un corte en planos 2C y 4C.
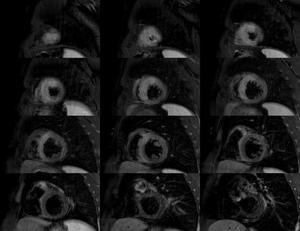
Fig. 2: Secuencia T2FSE doble IR , con saturación grasa, en eje cortoincluyendo todo el VI desde el ápex a la base. Se observa hiperseñal en relación con edema en territorio de arteria descendente anterior(DA), en paciente con IAM.
Hemorragia: se confirma como "pérdida de señal",
utilizando una secuencia Eco de Gradiente (EG) multieco,
(secuencia de corte único,
sangre negra multieco TFE con TE entre 2,6 y 14/21ms).
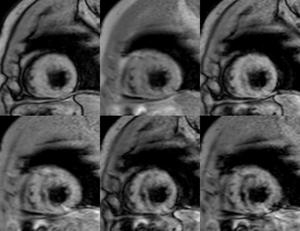
Fig. 3: Secuencia Eco de Gradiente (EG) multieco, (secuencia de corte único, sangre negra multieco TFE). El área de pérdida de señal en el septo indicad hemorragia. A medida que incrementamos el TE y por tanto la susceptibilidad magnética, se hace más evidente el sangrado intramiocárdico,debido al efecto paramagnético de la deoxihemoglobina.
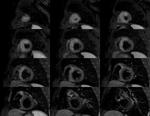
Perfusión miocárdica: Se obtienen imágenes en EC a tres niveles del VI (apical,
medio,
basal),
durante la primera inyección de un bolo de Gadoteridol (ProHance),
(0.075 to 0.10 mmol/kg a 4-5 ml/s).
Se utiliza una secuencia balanced-TFE de disparo único con gating prospectivo. La técnica permite delimitar la isquemia y áreas de OM.
Solo se realiza en pacientes con isquemia aguda.
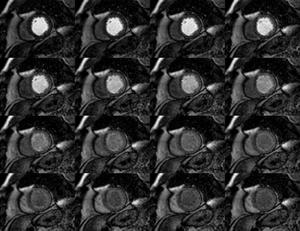
Fig. 4: Imagen de perfusión en reposo, EC.
Realce precoz (RP), Se obtienen también imágenes en EC,
a tres niveles del VI (apical,
medio,
basal), durante los cuatro minutos iniciales tras la inyección de 0.1-0.15 mmol/kg de gadoteridol,
(ProHance ).
Empleamos una secuencia EG 2D IR,
con respiración sostenida,
para la adquisición de imágenes.
Solamente se realiza en isquemia aguda.
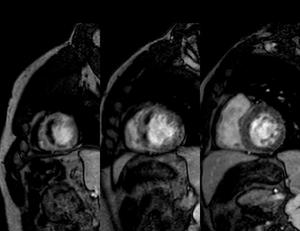
Fig. 5: Imágenes en EC, EG T1 2D IR (apical, medio, basal), obtenidas 2 minutos tras la administración de contraste. Las zonas de baja señal implican MO/hemorragia (daño post-reperfusión)
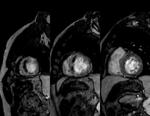
Realce Tardío (RT): se obtienen imágenes cubriendo todo el VI,
6-20 minutos tras la administración de 0.1-0.15 mmol/kg de gadoteridol,
(ProHance ). Empleamos una secuencia EG 2D IR,
con respiración sostenida,
para la adquisición de imágenes.
Los tiempos de inversión (TI) se ajustan individualmente para anular la señal del miocardio normal.
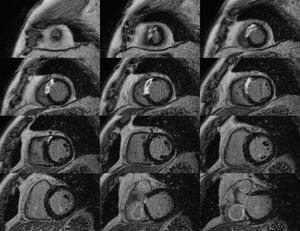
Fig. 6: Imágenes de RT cubriendo todo el VI, del ápex a la base. El realce tardío representa el área de infarto.
- Las secuencias de sangre blanca,
T2-balanced TFE,
se utilizaron para evaluar la función cardíaca global y segmentaria y los volúmenes del VI.
- Las secuencias FSE-T2 IR con saturación grasa y las secuencias con contraste permitieron evaluar el área de riesgo,
tamaño del infarto y el miocardio salvado y la OM.
- La RMCT2* nos permitió detectar hemorragia.
Todos ellos parámetros con potencial implicación clínica y valor pronóstico
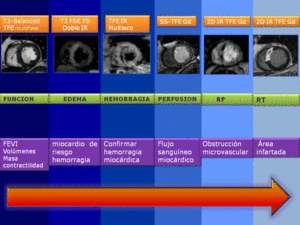
Fig. 7: Resumen del Protocolo de estudio de RMC en el IAM
2-RESULTADOS
A los 10 segundos de la interrupción del flujo sanguíneo se inician las alteraciones metabólicas,
le siguen las alteraciones de la contractilidad miocárdica (primero con disminución de la función diastólica y después alteraciones de la función sistólica) y finalmente cambios en el ECG con dolor torácico de tipo anginoso.
Hasta aquí la situación es reversible.
Cuando han transcurrido 20-30 minutos de isquemia,
empieza la necrosis miocárdica.
La necrosis siempre se inicia en el borde endocárdico y a medida que transcurre el tiempo va progresando hacia el borde epicárdico de forma lenta en un periodo de 3 a 6 horas llegando a ser transmural.
A partir del inicio de la necrosis estamos en un estado de irreversibilidad.
La reperfusión puede retrasar el avance de la necrosis y limitar el tamaño del infarto.
La imagen con RMC,
proporciona información clínica útil y fundamental en la valoración de la cardiopatía isquémica,
permitiendo una adecuada valoración de la función y vólumenes del VI,
fácilmente reproductible,
detectando edema miocárdico o miocardio en riesgo (MR), localización y extensión de la necrosis, con adecuada valoración de la viabilidad miocárdica,
, tamaño del infarto, miocardio salvado (MS) y daño post-reperfusión: (OM/hemorragia).
Todos ellos parámetros con potencial implicación clínica y valor pronóstico.

Fig. 8
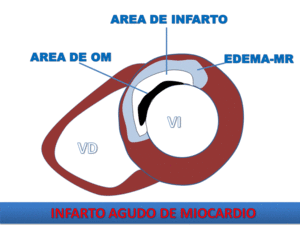
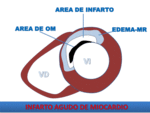
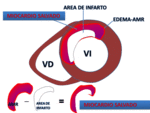
Fig. 9: Dibujo esquemático de los componentes del IAM. El edema en el miocardio de riesgo, puede visualizarse mediante secuencias T2 con saturación grasa o STIR. El área de infarto se delimita en las secuencias de RT. La OM mediante realce precoz o RT.
Isquemia- miocardio en riesgo:
El área de miocardio en riesgo,
se define como el área de miocardio afectada por ausencia de flujo sanguíneo, debido a la oclusión de una arteria coronaria, implicando isquemia y riesgo de necrosis miocárdica.
El signo más precoz de daño celular,
potencialmente reversible,
es el edema.
Las secuencia de doble IR T2,
con saturación grasa,
permiten detectar el miocardio isquémico edematoso,
con riesgo potencial de necrosis,
permitiendo la cuantificación del área de miocardio en riesgo (AMR).
Se muestra como hiperseñal mayor que la del resto del miocardio en el territorio vascular de la arteria afectada.
El AMR,
refleja la isquemia reversible e irreversible,
permitiendo delimitar el área viable peri-infarto.
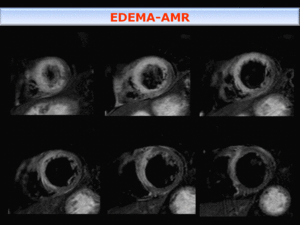
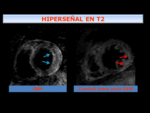
Fig. 10: El área de miocardio en riesgo (AMR)- Se muestra como hiperseñal mayor que la del resto del miocardio, que traduce edema transmural, en zona septal, apical y cara anterior del VI, en el territorio vascular de la arteria descendente anterior(ADA).
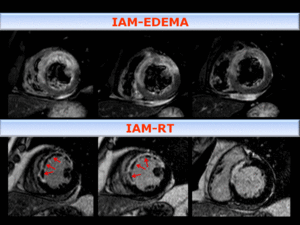
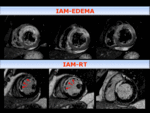
Fig. 11: Arriba:Imagen de RMC T2 IR con saturación grasa en EC , que muestra hiperseñal, edema, en el área de riesgo. Se observa un centro hipointenso que indica OM/hemorragia, que se correlaciona con las imágenes de RT (abajo), como ausencia de captación dentro del área infartada, (flechas naranja).
Observamos en el grupo de pacientes con IAM y con tratamiento precoz de reperfusión,
persistencia en algunos casos de hiperseñal en secuencias T2 con saturación grasa,
en el área infartada en los estudios de control al mes post-IAM.
EL miocardio ya no se visualiza expandido debido al edema,
como en el infarto agudo y la alteración de señal es menos prominente.
Suponemos que refleja tejido de granulación o fibrosis inmadura,
con un comportamiento similar al músculo esquelético lesionado.
Sin embargo sería necesaria una adecuada correlación anátomo-patológica para establecer la causa exacta de la persistencia de la hiperseñal un mes tras el infarto o estudios posteriores para determinar además el tiempo de persistencia de dicha alteración de señal tras el IAM.
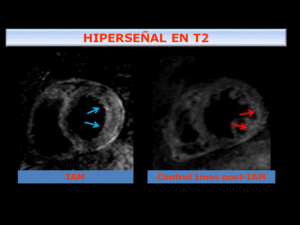
Fig. 12: Imagen T2 IR FSE SPIR en EC: Paciente con infarto en cara lateral debido a oclusión de arteria circunfleja. Se observa en el estudio inicial edema miocárdico con aumento del grosor del miocardio y mayor señal que el miocardio remoto (flechas azules). En el estudio de control 1 mes post-IAM se observa discreto adelgazamiento del miocardio y persistencia de discreta hiperseñal (flechas naranjas)
Necrosis-tamaño del infarto:
Durante la oclusión coronaria,
la isquemia progresa del endo al epicardio.
Si la isquemia persiste,
el daño miocárdico se vuelve irreversible y se traduce en necrosis. La RMC con RT permite delimitar la extensión del área necrótica-tamaño del infarto.
El miocardio infartado,
necrótico,
se objetiva como un área de hipercaptación de contraste ("bright is dead"), 6-20 minutos tras la administración de contraste,
que es típicamente subendocárdico o transmural y afecta a un territorio vascular.
El RT refleja cicatriz o fibrosis.
Fig. 13: RT en paciente con infarto isquémico en territorio de arteria circunfleja . El incremento regional degadolinio extracelular produce acortamiento del T1 en el miocardio patológico, que se manifiesta como hiperrealce en el estudio de realce tardío.
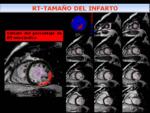
Mediante un modelo semiautomático de RMC,
es posible calcular el tamaño del infarto como un volumen o un porcentaje del miocardio total.
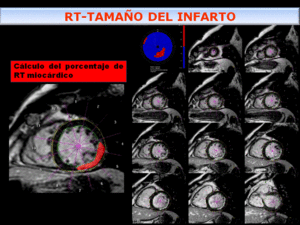
Fig. 14: Representación esquemática del calculo de porcentaje de miocardio con RT. Es necesario dibujar contornos endo y epicárdicos y seleccionar un umbral para delinear el área de RT desde el ápex hasta la base y obtener el porcentaje de miocardio realzado.
Miocardio viable es aquel cuya capacidad contráctil está disminuida como consecuencia de una situación de isquemia aguda (aturdimiento) o crónica (hibernación),
y que puede recuperar su función tras la revascularización coronaria.
La presencia de RT,
que traduce fibrosis,
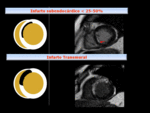
afectando a más del 50% del grosor parietal indica que es poco probable la recuperación de la función contráctil.
Una extensión mayor del 75% tendría un valor predictivo negativo del 100%.
La determinación de la viabilidad miocárdica es crucial para la toma de decisiones clínicas en el manejo de la cardiopatía isquémica.
El momento óptimo para el estudio de la viabilidad miocárdica es a los 3-4 meses del IAM,
con el proceso de cicatrización ya finalizado.
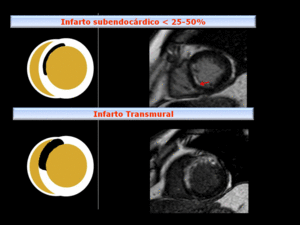
Fig. 15: Representación esquemática con ejemplos correlativos, de infartos con miocardio viable (RT<50%) y no viable (RT transmural).
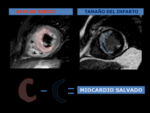
Miocardio salvado
El área de riesgo isquémica es siempre más extensa que el área de infarto,
delimitada mediante RT.
La cuantificación del miocardio de riesgo y tamaño de infarto, permite el cálculo de la cantidad de miocardio salvado en el infarto reperfundido,
que es el volumen de miocardio que la reperfusión salvó de la muerte celular por isquemia.
La necrosis miocárdica se define por la extensión del RT,
el miocardio en riesgo por la extensión del edema,
y el miocardio salvado por la diferencia entre ambos.
El índice de miocardio salvado (IMS) se obtiene mediante la fórmula (área de riesgo-tamaño del infarto)/área de riesgo.
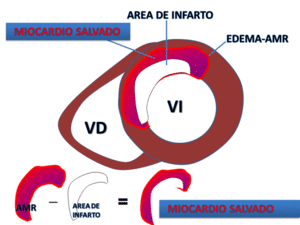
Fig. 16: Representación esquemática del cálculo de MIOCARDIO SALVADO. La diferencia entre el edema en el área de riesgo visualizado en secuencias potenciadas en T2 y el área de infarto, delimitada por el realce tardío representa el área potencial de MIOCARDIO SALVADO.
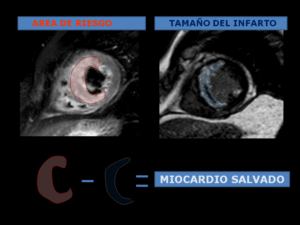
Fig. 17: CÁLCULO DEL MIOCARDIO SALVADO (MS). La cuantification del AMR y del tamaño del infarto, permite el cálculo de la cantidad de miocardio salvado. Miocardio de riesgo-necrosis miocárdica= miocardio salvado
Tamaño del infarto y miocardio salvado son parámetros con valor pronóstico a la hora de establecer el riesgo de morbi-mortalidad en pacientes con IAM.
Friedrich y col.
han publicado datos prometedores sobre la importancia del cálculo del índice de MS (IMS).
Estudios posteriores establecen el IMS como un determinante con valor pronóstico superior al tamaño del infarto.
Masci y col. mostraron con su estudio que el IMS obtenido mediante RMC,
constituye un determinante mayor e independiente de dos importantes parámetros clínicos y pronósticos,
como el remodelado del VI y la resolución precoz del ST.
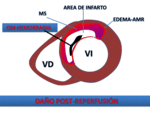
Daño post-reperfusión: "no-reflow", obstrucción microvascular y hemorragia.
La reperfusión precoz del miocardio isquémico (terapia trombolítica o angioplastia,
stent coronario) limita el tamaño del infarto,
preserva la función ventricular izquierda,
y mejora la supervivencia entre pacientes con IAM.
Sin embargo,
puede ocurrir que el territorio isquémico no pueda ser adecuadamente reperfundido de nuevo,
incluso si el flujo de sangre en la arteria coronaria previamente ocluida ha sido restablecido ("no-reflujo"). el fenómeno de "no reflujo",
se relaciona con fenómenos inflamatorios y trombóticos que producen obstrucción del lecho microvascular.
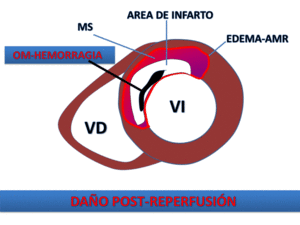
Fig. 18: Representación esquemática de los componentes de IAM reperfundido. mediante las secuencias de realce precoz o tardío se pueden delimitar las áreas de OM/hemorragia como áreas de ausencia de perfusión/realce postcontraste embebidas en el área de necrosis.
Los hallazgos macroscópicos asociados con el fenómeno de "no reflujo",
incluyen la necrosis miocárdica y la hemorragia difusa.
Las consecuencias patológicas de las estrategias de reperfusión: la obstrucción microvascular (MO) y hemorragia,
actualmente pueden ser detectadas con RMC.
Las áreas de ausencia realce en RP o RT ,
o que mantienen el defecto de perfusión durante el estudio de perfusión o de primer paso de contraste,
constituyen áreas de OM/ hemorragia.
Nosotros observamos que las técnicas de perfusión de primer paso en reposo y de realce precoz,
son más sensibles que las técnicas de RT para detectar OM. Las áreas de ‘no reflujo’ poco extensas realzan rápidamente con gadolinio debido a la la difusión del contraste extracelular de regiones adyacentes sin daño microvascular.
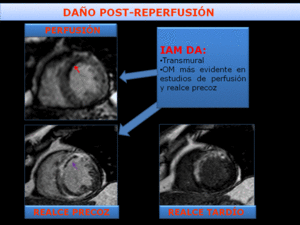
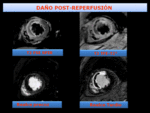
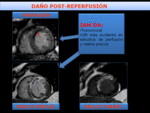
Fig. 20: Infarto transmural con OM-hemorragia. El paciente presentó un infarto anterior con elevación de ST. Se revasculariza la DA previamente ocluida con tratamiento percutáneo (PCI), entre las 2-3 h desde el establecimiento de los síntomas . La RMC se realizó los 5-7 días tras el evento. La secuencia de perfusión en reposo, muestra un defecto de perfusión persistente, hipointenso, reflejando OM. El estudio de RP muestra un área de hiposeñal que también refleja la OM. El estudio de RT no demuestra franca OM en el área de infarto transmural, representando la difusión del contraste en el área de OM con el tiempo.
La presencia de un área central hipointensa dentro del área de riesgo de un infarto reperfundido en secuencias T2 o T2*,
representa hemorragia.
La RMCT2*, permite detectar cambios en la intensidad de señal debido al efecto de susceptibilidad magnética de la deoxihemoglobina.

Fig. 19: Infarto transmural con OM-hemorragia. El paciente presentó un infarto anterior con elevación de ST. Se revasculariza la DA previamente ocluida con tratamiento percutáneo (PCI), entre las 2-3 h desde el establecimiento de los síntomas . La RMC se realizó los 5-7 días tras el evento. La imagen T2-Spir muestra hiperseñal en región anteroseptal, traduciendo edema miocárdico transmural con una extensa área central de baja señal, "dark zone". El Realce precoz(RP) muestra OM en el septo. Es francamente más evidente la OM en las secuencias de RP que en el RT, representando la difusión del gadolinio en el área de OM con el tiempo. La imagen de RMCT2* muestra pérdida de señal de la zona centra, "dark zone", reflejando y confirmando la presencia de hemorragia debido al efecto paramagnético de la deoxihemoglobina.
En nuestra serie objetivamos que el daño post-reperfusión severo ocurre habitualmente cuando la necrosis es transmural y es mayor el porcentage de miocardio realzado (tamaño del infarto),
que se asocian con disfunción ventricular izquierda y un curso clínico adverso.
Remodelado ventricular.
El fenómeno de remodelado ventricular adverso tras un IAM se caracteriza por una dilatación precoz de la región necrótica y periinfarto,
con una posterior extensión a zonas inicialmente sanas del miocardio que conlleva cambios en la forma y el tamaño ventriculares (esfericidad y dilatación) que desembocan en disfunción sistólica e insuficiencia cardiaca.
Tiene graves implicaciones pronósticas.
La función del VI y su repercusión sobre el remodelado del VI se manifiesta como aumento de volúmenes.
El remodelado adverso del VI debido a la expansión del infarto,
implica adelgazamiento,
atrofia del segmento necrótico asociado con dilatación y a menudo hipertrofia del miocardio remoto.
La RMC es la técnica más fiable y reproducible para cuantificar volúmenes y masa ventriculares.
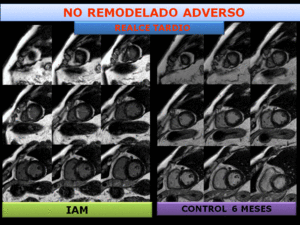
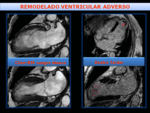
Fig. 21: infarto miocárdico septal no transmural. El estudio de control a los 6 meses, muestra disminución del tamaño del infarto y ausencia de remodelado del VI. El curso clínico fue bueno.
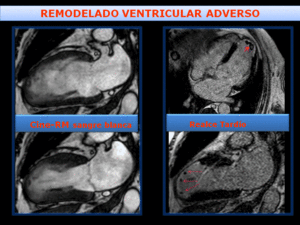
Fig. 22: Remodelado adverso del VI, tras infarto en territorio de DA, con aneurisma apical y trombos apicales (flechas rojas). Izquierda- imágenes de sangre blanca en diástole(arriba) y sístole(abajo), que muestran el aneurisma apical con hipertrofia del miocardio remoto.
Derecha- imágenes de RT 4C Y 2C que muestran realce transmural del aneurisma y presencia de trombos apicales.
- El tamaño del infarto (porcentaje de miocardio realzado),
- La extensión transmural.
- La OM/hemorragia.
son parámetros de imagen que indican elevado riesgo de remodelado adverso,
con mayor valor predictivo que otros parámetros clínicos.
COMPLICACIONES POST-INFARTO
La RMC tambien desempeña un papel clave en la detección y evaluación de complicaciones post-infarto.
- Aneurisma y pseudoaneurisma: discinesia y dilatación del miocardio adelgadazo con realce transmural,
siendo en el pseudoaneurisma mayor el realce peri´cardico y menos el diámetro proximal.
- Trombos: La CMR ofrece mejor resolución y contraste para la detección de trombos.
El RT tiene una sensibilidad del 88% y una especificida del 99% en la detección de trombos.
- Rotura del septo o pared libre del VI: muestra la discontinuidad del miocardio.
- Regurgitación mitral: Cine SSFP CRM permite identificar y caracterizar el mecanismo de regurgitación y la severidad se puede cuantificar mediante secuencias de codificación de fase allows identification and characterization of the mechanism of
- Infarto del VD y aurícula derecha: visibles mediante técnicas de RT.
- Fallo cardíaco congestivo: el uso combinado de secuencias balanced-T2TFE y RT permite comprender el mecanismo del fallo cardíaco.
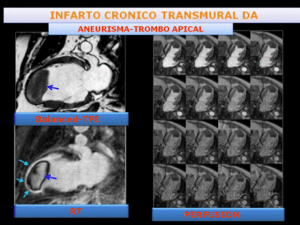
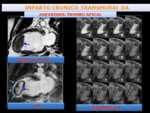
Fig. 23: Paciente con infarto isquémico crónico en territorio de DA, con aneurisma apical y gran trombo endocavitario.
La imagen de RMC balanced-T2 TFE,2C- muestra un aneurisma apical y masa endocavitario. En la imagen de RT en 2C se observa realce transmural en territorio de DA y delimita un trombo apical(flechas). El estudio de perfusión en reposo, muestra ausencia de realce del trombo apical.
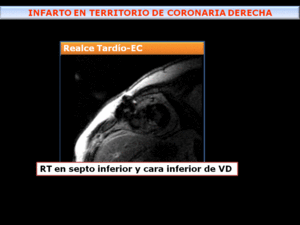
Fig. 25: Secuencia de RT a nivel del expele- se observa Realce Tardío transmural, inferoseptal del VI e inferior de VD en paciente con infarto en territorio de arteria coronaria derecha.
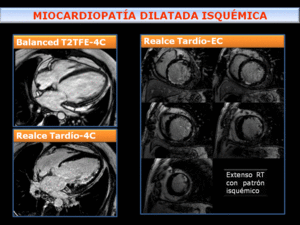
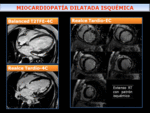
Fig. 24: Miocardiopatía dilatada (MCD) isquémica- dilatación del VI en paciente con disfunción sistólica. El estudio de RT pone de manifiesto realce con patrón isquémico, que se extiende desde el subendocardio en diferentes territorios vasculares con resultado de MCD de origen isquémico.