Animales
El estudio experimental se realizó en 18 ratas macho WAG/RijCrl de 2,5 meses de edad y 211-263g de peso.
Todos los procedimientos se practicaron de acuerdo con la legislación estatal vigente referente a la protección de los animales utilizados para experimentación y otros fines científicos.
Las ratas se mantuvieron en un estabulario a condiciones estándar: temperatura media de 22ºC,
humedad relativa del 55%,
patrón alternante de 12 horas de luz y de oscuridad,
y alimentación a base de pienso estándar y agua “ad libitum”.
Fluido Magnético
El magnetofluido se elaboró a partir de nanopartículas magnéticas de Fe3O4,
de 25nm.
En el proceso de síntesis,
las nanopartículas eran rodeadas de ligandos orgánicos lipídicos,
especialmente acido oleico,
que mediante ultrasonificación permitían su suspensión en el Clinoleic® 20%.
De este modo,
se prepararon suspensiones de entre 3,5 y 5,5mg de nanopartículas de óxido de hierro en 0,4ml de Clinoleic® 20%,
que posteriormente serían infundidas individualmente a cada animal,
por vía percutánea intratumoral.
Anestesia
En el proceso de inoculación tumoral,
los animales se mantuvieron bajo anestesia inhalada inducida por Halotano.
Para la práctica de las exploraciones ecográficas,
la infusión intratumoral de los fluidos magnéticos,
y los estudios de RM,
se utilizó anestesia intraperitoneal a base de una inyección de Diazepam (25mg/kg) combinada posteriormente a los diez minutos con Ketamina (100mg/kg).
Inducción tumoral
En el día 0 del experimento a los animales se les practicó una laparotomía media subxifoidea para exponer el hígado.
Posteriormente se realizó punción subcapsular directa en el lóbulo hepático izquierdo,
para inyectar 25.000 células singénicas de adenocarcinoma de colon (línea celular: CC-531) suspendidas en 0,05ml de solución de Hank.
Control del desarrollo tumoral
Para monitorizar el desarrollo y progresión de las lesiones neoplásicas hepáticas,
a los animales se les realizaron ecografías abdominales seriadas a los 21 y 28 días de la inyección tumoral.
Las ecografías se practicaron en un ecógrafo “MyLab60 XVision” de Esaote,
dotado con una sonda lineal multi-frecuencia de 6-18 Mhz.
Como paso previo a la ecografía fue necesario depilar la mitad superior del abdomen de las ratas mediante la aplicación de una crema depilatoria estándar.
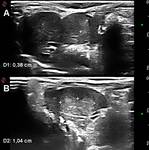
Como signos ecográficos de desarrollo neoplásico se consideraron los siguientes hallazgos (Fig.1):
- Nódulos intra-hepáticos de eco-estructura diferente y distinguible del parénquima circundante.
- Festoneado del contorno hepático motivado por abombamientos focales en la superficie de la víscera.
Procedimiento de infusión eco-guiada del magnetofluido
En el día 28 se procedió a la infusión intratumoral de los magnetofluidos,
en diez animales que habían desarrollado lesiones neoformativas.
Los diámetros máximos de los tumores fueron: mediana 8mm (rango: 10-4mm).
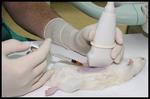
El procedimiento de infusión se practicó mediante punción directa transparietal de las lesiones neoplásicas,
guiada por ecografía y con técnica de manos libres.
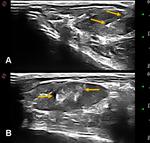
Este procedimiento permitía visualizar la masa tumoral mientras se puncionaba directamente con una aguja de 30G conectada a una jeringa precargada con los magnetofluidos (Fig.2).
Tras verificarse la correcta ubicación intratumoral de la aguja se instilaban lentamente los magnetofluidos en el interior de los tumores (Fig 3).
En el caso de tumores grandes se requirieron de dos o tres punciones,
en lugares diferentes,
para alcanzar la mayor parte del tejido neoplásico.
Una vez administrado todo el fluido se retiraba la aguja y se realizaba presión sobre la superficie hepática con la propia sonda ecográfica para favorecer la hemostasia.
Estudios de RM
A las seis horas de la infusión de los magnetofluidos se realizaron los estudios de RM para valorar la idoneidad de la infusión.
En un equipo de RM de 1,5 T,
Siemens “Symphony”,
y con los animales en una bobina de cráneo,
se practicaron secuencias axiales STIR [TR: 3600ms; TE: 20ms; TI: 130ms (3600/20/130); espesor de corte: 3mm; matriz: 288x512] y gradiente de eco (GRE) [120/4 (DP*) y 120/14 (T2*); ángulo: 20º; espesor de corte: 3mm; matriz DP*:312x512; matriz T2*: 288x512].
En las secuencias STIR,
las lesiones neoplásicas se comportarían como nódulos hiperintensos dentro del parénquima hepático hipointenso.
En las secuencias GRE se consideró que la disminución de la intensidad de la señal,
más acusada en las secuencias T2*,
motivada por la presencia de las nanopartículas de óxido de hierro,
indicaría la ubicación del magnetofluido previamente inyectado.