CONCEPTOS BÁSICOS BIOLÓGICOS DE LA SECUENCIA DE DIFUSIÓN Y ASPECTOS TÉCNICOS EN 3T
La imagen de difusión depende del movimiento microscópico aleatorio del agua en respuesta a un estímulo térmico conocido como movimiento Browniano (2).
Los espacios con gran cantidad de fluido (como la vejiga y la vesícula) presentan difusión libre e isotrópica El movimiento de las moléculas de agua en el interior de los tejidos orgánicos no es totalmente aleatorio (o browniano),
ya que se encuentra limitado por la celularidad tisular,
organización tisular,
tortuosidad del espacio extraaxial e integridad de las membranas celulares.
Por lo tanto,
la densidad celular y el estado de las membranas celulares son factores determinantes del grado de limitación (o restricción) del movimiento de las moléculas de agua y,
por consiguiente,
de la imagen final obtenida en RM (3,
4,
5).
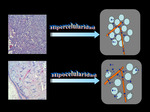
Los tejidos o estructuras con alta densidad celular (por ejemplo,
tumores hipercelulares,
abscesos) representan limitación en el movimiento de las moléculas de agua (o difusión restringida),
mientras que aquellos con baja densidad celular (por ejemplo,
quistes simples,
vejiga,
vesícula biliar,
conductos,
etc.) ó con membranas alteradas (por ejemplo,
tejidos necróticos) permiten un mayor movimiento molecular (o ausencia de restricción) (3,5).
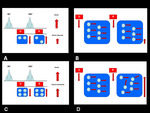
Las secuencias de difusión se encuentran basadas en la secuencia convencional spin-echo (SE) ponderada en T2 (pulso de radiofrecuencia de 90º seguido por otro pulso de radiofrecuencia de 180º) a la que Stejskal y Tanner le aplicaron un par simétrico de gradientes con polaridad opuesta (uno de ellos previo al pulso de 180º y otro posterior al pulso de 180º),
logrando de esta manera medir la difusión de las moléculas de agua,
efectos demasiados pequeños como para ser visibles en la RM convencional (6).Con la aplicación del pulso de radio-frecuencia (RF) de 90º se logra que todas las moléculas contenidas en el interior de un vóxel presenten la misma fase. Posteriormente,
y tras la aplicación del primer gradiente, se logra un rápido desfase (o pérdida de fase) de las moléculas de agua.
La aplicación del segundo gradiente,
tras el pulso de 180º,
refasarán solamente los protones que tengan la misma posición a la presentada previo al primer gradiente (7).
Cuando las moléculas de agua presentan libre movimiento pueden desplazarse a una distancia considerable entre la aplicación de ambos gradientes.
Por lo tanto,
dichas moléculas no refasan completamente después del segundo gradiente,
dando como resultado una pérdida de la intensidad de señal.
Por su parte,
cuando las moléculas de agua presentan limitación de movimiento,
no pueden movilizarse a grandes distancias entre la aplicación de ambos gradientes (9).
Los cambios de fase obtenidos después del primer gradiente son entonces anulados por los cambios de fase logrados tras la aplicación del segundo gradiente evitando pérdida de intensidad de señal neta y preservando la señal T2 del tejido (8).
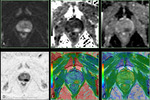
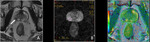
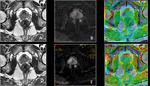
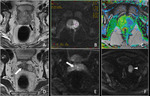
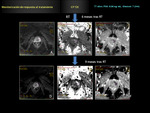
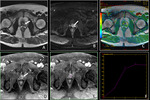
Las imágenes de difusión en RM deben ser valoradas de manera cualitativa y cuantitativa (mapa ADC).
Fig. 1 Fig. 2
a) Valoración cualitativa (visual) y valor b
La sensibilidad de la secuencia de imagen a la difusión del agua varía de acuerdo con el valor b o factor b utilizado.
El valor b depende de la amplitud,
duración del gradiente y del intervalo de tiempo existente entre la aplicación de ambos gradientes (10).
En los estudios de difusión,
el operador selecciona los valores b con los que quiere potenciar la imagen.
Generalmente se adquieren dos o tres valores b,
incluyendo uno de 0 s/mm2 (sin potenciación en difusión) y uno más alto (habitualmente entre 500-1000 s/mm2) (8).
Lógicamente,
el valor b máximo se encuentra limitado por la potencia de los gradientes (10).
Por cada valor b seleccionado se obtiene una secuencia de imágenes y el número de imágenes que lo componen se determina en la programación.
Cada una de las imágenes adquiridas en cada secuencia son representadas y pueden ser evaluadas cualitativamente (9,10).
Existen varias alternativas para presentar esas imágenes,
pero,
debido a que la señal adquirida es esencialmente no cuantitativa,
suelen representarse en escala de grises (a veces invertida) o en escalas con colores arbitrarios (mapa de color del ADC) (6).
Asimismo,
las imágenes pueden ser procesadas con modernos programas de software,
lográndose imágenes con reconstrucción multiplanar,
proyección de intensidad máxima (MPR y MIP) e incluso representación de volumen (volume rendering).
Pueden también fusionarse las imágenes de difusión con las obtenidas con las secuencias “convencionales”.
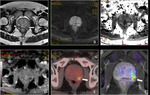
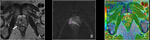
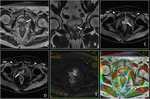
Fig. 3
Las imágenes adquiridas con valores b bajos (por ejemplo,
50 s/mm2) se caracterizan por presentar buena relación señal/ruido (S/R),
pero escasa ponderación de difusión.
A medida que el valor b aumenta,
la sensibilidad de la secuencia de difusión se incrementa,
aunque a expensas de una reducción de la relación S/R,
de una mayor distorsión de la imagen y de un aumento del tiempo de eco (3).
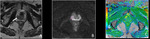
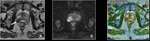
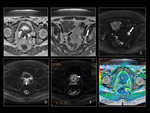
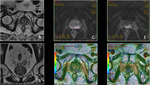
b) Valoración cuantitativa: mapa ADC
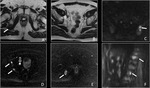
La segunda etapa del análisis de las secuencias de difusión consiste en el análisis cuantitativo del coeficiente de difusión aparente (o mapa ADC) (3,4).
En términos matemáticos,
el cálculo o mapa ADC (independiente del campo magnético) se obtiene en cada vóxel y se expresa en mm2/s.
ADC = −ln (S1 / S0) /b (S1: señal de intensidad en las imágenes de difusión,
S0: intensidad de señal en imágenes sin ponderación de difusión,
y b: el factor gradiente de la secuencia de pulso)
El ADC suele ser presentado como una imagen paramétrica en escala de grises (valoración visual del mapa ADC) que refleja las diferencias de difusión de las moléculas de agua en un sector determinado.
También pueden seleccionarse áreas de interés (ROI en el interior del mapa ADC para determinar el promedio (o ADC medio) de un tejido o área específica que se expresa en mm2/s (10).
Un valor de ADC bajo indica restricción de la difusión y áreas de alta celularidad mientras que un valor alto de ADC indica áreas con menor celularidad.
Fig. 4 Fig. 5 Fig. 6
c ) Aspectos técnicos en 3T:
La imagen de difusión prostática se obtiene con técnicas eco-planar (EPI) que son susceptibles a los artefactos de susceptibilidad que son exacerbados por la presencia de aire o metal.
Para reducir estos artefactos los equipos de 3T aplican técnicas de
acquisición de imagen en paralelo las cuales permiten reducir el tiempo de eco (TE) y el número de ecos y aumentar el ancho de banda.
Los equipos de 3T incrementan la ratio señal/ruido (SNR) y permite utilizar valores altos de b (> 1,000 s/mm2 y menor grosor de corte (≤ 3mm).
En nuestro centro los estudios han sido realizados en un equipo 3 T HDXT,
General Electric con una antena de ocho canales (TORSO PA coil).
La imagen de difusión forma parte del protocolo de rutina de la RM prostática y se utiliza la secuenciasingle- shot echo-planar con las mismas localizaciones que la imagen potenciada en T2.
Se aplican dos gradientes bipolares uno con valor b 0 y otro con valor b 1000s/mm2 en las tres direcciones,
en el plano axial.
Los parámetros son los siguientes:TR 6275 ms,
TE 68,1ms ,
ancho de banda 250 khz,
FOV 38x 26,6 cm,
espesor de corte 3mm,
distancia entre cortes 0 mm,
matriz 128x128,
10 NEX,
factor de aceleración 2,supresión de grasa b 0 y 1,000 s/mm2, duración 4m 17s.
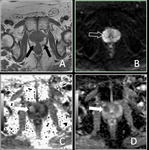
La imagen difusión y el ADC son herramientas poderosa en la caracterización del tejido prostático,
particularmente en la diferenciación de benigno y maligno.
En la imagen de difusión el tejido prostático sano muestra pérdida de señal.
Como en otros cánceres,
el CP tiene mayor densidad celular y mayor cantidad de membranas intra e intercelulares comparado con el tejido glandular normal que restringe la difusión con aumento de señal en la imagen de difusión (11).
La intensidad de señal observada depende de la difusión del agua y del tiempo de relajación en T2.
Así un área con un tiempo de relajación en T2 muy largo puede aparecer hiperintenso en la imagen de difusión simulando restricción de la difusión (efecto T2).
Una solución simple es utilizar la imagen exponencial que se obtiene de la relación imagen de difusión /imagen de b = 0 s/mm2,
en la misma serie y la misma posición.
También se puede utilizar mapas de ADC en escalas de grises donde estas áreas del efecto T2 aparecerán hipointensas siendo posible además su cuantificación.
Otras formas de disminuir el efecto T2 es aumentar el valor de b y acortar el TE (3).
La secuencia eco-planar de la imagen de difusión es muy sensible a las heterogenidades del campo magnético,
sobre todo por la presencia de gas gastrointestinal (12).
Para disminuir estos artefactos en pelvis,
nuestros estudios se realizaron con enema de limpieza previo.
APLICACIONES CLíNICAS
El CP es cáncer más frecuente en varones,
supone el 25% de todos los cánceres en varones en 2009 frente al 15% del carcinoma de pulmón.
Es la segunda causa de muerte por cáncer (9% de las muertes por cáncer en varones),
por detrás del carcinoma de pulmón (30% de las muertes por cáncer en varones).
16%
de los varones (1 de cada 6) desarrollará carcinoma prostático en su vida.
La prevalencia del CP incrementa con la edad; 34% de los varones en la 5ª década y más del 70% de los varones a partir de 80 años.
En los últimos 25 años la supervivencia a 5 años de todos los estadios ha aumentado del 69 al 99%.La supervivencia a 10 años es del 93% y a 10 años del 79% (13).
Esta mejora de la supervivencia,
sobre todo a 5 años,
se debe al diagnóstico precoz y la mejora del tratamiento.
El cribado de CP está basado en la elevación del antígeno prostático específico (PSA) y el tacto rectal,
ambas técnicas con subóptima exactitud diagnóstica para el diagnóstico del CP.
Entre un 15-44% de los carcinomas confirmados por biopsia afectan a pacientes con niveles de PSA por debajo de 4 ng/ml.
En un 15,2% de los pacientes con CP con niveles de PSA normales,
los tumores no son palpables y son clínicamente silentes (14).
En los casos de PSA bajo o intermedio podemos utilizar el nivel de PSA libre,
así un valor inferior a 20-25% es indicación de biopsia.
Un PSA libre mayor de 18% se asocia a un riesgo de CP inferior al 10%; con un valor de PSA libre inferior al 10% el riesgo de CP es del 30% (15).
Detección del CP (localización del tumor y pronóstico).
La imagen de difusión ayuda a localizar el tumor en pacientes con biopsia transrectal negativa.
El uso combinado de secuencias de difusión y secuencias potenciadas en T2 en 3T ha mejorado la sensibilidad siendo del 81-84% comparado con 54-73% si se utilizan solamente secuencias T2 (16).
La sensibilidad de los valores de ADC en la zona periférica es del 98%,
comparado con el 81% de la zona transicional,
aunque no existen diferencias significativas en especificidad (17).
Los valores de ADC obtenidos en la secuencia de difusión en 3 T son significativamente menores en los carcinomas prostáticos que se encuentran incluidos en el grupo de riesgo intermedio o alto de la escala de D’Amico y en los carcinomas que presentan un score Gleason mayor,
existiendo una correlación negativa significativa; el ADC puede,
por tanto,
predecir la agresividad del CP (18).
Un grupo de expertos en RM prostática de la Sociedad Europea de Radiología Urogenital han elaborado unas guías clínicas de RM prostática multiparamétrica basadas en la evidencia de la literatura y en el consenso de los expertos.
Además han creado un score PIRADS (Prostate Imaging Reporting and Data System),
similar al de mama (BI-RADS) en el que se incluye secuencias T2,
imagen de difusión,
estudios dinámicos tras contraste y espectroscopía (19).
Score en la secuencia de difusión:
Score 1- No existe reducción del ADC comparado con el tejido glandular normal.
No se observa incremento de señal en cualquier valor de b≥ 800 s/mm2.
Score 2- Hiperintensidad difusa en imágenes de b≥ 800 s/mm2 con ADC bajo sin lesiones focales; las imágenes lineales,
triangulares o de distribución geográfica se incluyen en este grupo.
Score 3- Apariencia intermedia,
no se puede incluir en las categorías 1-2 o 4-5.
Score 4- Área(s) focal (es) de reducción del ADC pero isointenso en imágenes de b≥ 800 s/mm2.
Score 5-Area focal /masa con hiperintensidad en imágenes de b≥ 800 s/mm2 con bajo ADC.
Significado clínico del score de 5 puntos del PI-RADS:
Score 1: La presencia de enfermedad clínicamente significativa es muy improbable.
Score 2: La presencia de cáncer clínicamente significativo es improbable.
Score 3: La presencia de cáncer clínicamente significativo es indeterminada.
Score 4: La presencia de cáncer clínicamente significativo es probable.
Score 4: La presencia de cáncer clínicamente significativo muy probable.
La hemorragia prostática postbiopsia puede disminuir los valores de ADC en el tejido prostático normal dificultando la diferenciación del CP de la próstata normal.
Además esto puede incrementar los artefactos de distorsión.
Un estudio reciente demostró que aproximadamente un 65% de los estudios realizados en 3T a pacientes 3 semanas después de la biopsia tenían calidad suficiente para el diagnóstico (20).
Sin embargo una hemorragia aguda en la semana siguiente a la biopsia puede impedir el diagnóstico del CP,
siendo recomendable esperar al menos 4-6 semanas.
Estadificación del carcinoma prostático,
riesgo de recurrencia y tratamiento del CP.
La imagen de difusión nos permite mejorar la estadificación del CP,
tanto en tumores localizados para diferenciar entre estadios de bajo riesgo (T2A) de los estadios de riesgo intermedio (T2 B,
T2 C) como de los tumores con afectación extraprostática.
En el trabajo de Kim y colaboradores (21) proponen que el uso de la imagen de difusión junto con las imágenes potenciadas en T2 mejora la predicción de invasión de las vesículas seminales comparado con la utilización sólo de secuencias T2 con una exactitud diagnóstica superior al 90%.
A pesar del excelente contraste de los tejidos de partes blandas en la RM,
la técnica tiene un valor limitado en la valoración metastásica ganglionar; con una exactitud diagnóstica similar a la de la tomografía computarizada.
No existe un criterio unificado para indicar el nivel de corte del tamaño ganglionar,
pero se acepta como valor máximo el de 8 mm para ganglios redondos y 10 mm para ganglios ovalados medido en el eje corto del ganglio.
La secuencia de difusión facilita por tanto la detección de adenopatías tanto regionales como a distancia pero no mejora la exactitud diagnóstica. Se han desarrollado unos contrastes órgano-específicos como las micropartículas de óxido de hierro súper-paramagneticas (USPIO) para realizar linfografías con RM que mejora la sensibilidad y especificidad para la detección metastásica ganglionar (22).
De todas formas la utilización de este contraste órgano-específico no ha sido aprobada para la práctica clínica.
En el trabajo de Beheshti M y colaboradores muestran el valor del PET-TAC con 18-F-Colina para detectar adenopatías metastásicas de tamaño igual o superior a 5mm en pacientes de alto riesgo con una sensibilidad,
especificidad,
valor predictivo positivo y valor predictivo negativo de 66%,
96%,
82%,
and 92%,
respectivamente (23).
El empleo de la secuencia de difusión de toda la pelvis en el protocolo de estudio permite detectar de forma eficaz las lesiones óseas,
pudiendo incluso realizar RM de cuerpo entero con difusión.
Los resultados indican una exactitud diagnóstica superior de la RM respecto a la gammagrafía ósea (24).
TNM
Tumor primario (T)
- TX: Tumor primario no puede ser evaluado.
- T0: No hay prueba de tumor primario.
- T1: Tumor clínicamente no aparente,
no palpable ni visible mediante imágenes
- T1a: Descubrimiento histológico incidental del tumor en menos del 5% del tejido resecado.
- T1b: Descubrimiento histológico incidental del tumor en más del 5% del tejido resecado.
- T1c: Tumor identificado por biopsia de aguja (por ejemplo,
a causa de PSA elevada).
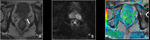
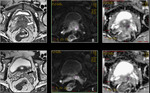
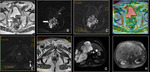
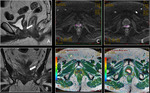
- T2: Tumor confinado dentro de la próstata
- T2a: El tumor afecta 50% de un lóbulo o menos.
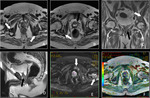
Fig. 7 Fig. 8
- T2b: El tumor afecta más del 50% de un lóbulo pero no ambos lóbulos.
Fig. 9 Fig. 10
- T2c: El tumor afecta ambos lóbulos.
Fig. 11
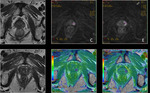
- T3: El tumor se extiende a través de la cápsula prostática
- T4: El tumor está fijo o invade estructuras adyacentes distintas a las vesículas seminales: el cuello de la vejiga,
el esfínter externo,
el recto,
los músculos elevadores o la pared de la pelvis.
Fig. 16 Fig. 17
Ganglios linfáticos regionales (N):
- NX: Ganglios linfáticos regionales no fueron evaluados
- N0: No existe metástasis ganglionar linfática regional
- N1: Metástasis en ganglio(s) linfático(s) regional(es)
Metástasis a distancia (M)*
- MX: Metástasis a distancia que no puede ser evaluada (no evaluada por modalidad alguna)
- M0: No hay metástasis a distancia
- M1: Metástasis a distancia
- M1a: Ganglio(s) linfático(s) no regional(es)
- M1b: Hueso(s)
- M1c: Otro(s) sitio(s) con enfermedad ósea o sin esta.
La importancia de una correcta estadificación radica en el valor pronóstico y posibilidades de tratamiento.
El carcinoma prostático se considera de.
Valor pronóstico:
- De bajo riesgo de recidiva: si tiene un PSA< 10ng/ml,
un Gleason de 2-6 y un T1 o T2A.
- De riego intermedio: si tiene un PSAentre10-20 ng/ml,
un Gleason de 7 o T2B o T2C.
- De alto riesgo: si tiene un PSA >20 ng/ml,
un Gleason de 8-10 o T3A.
- Localmente avanzado T3B oT4.
- Metastásico: N1 con cualquier T.o M1 con cualquier T.
Tratamiento:
- De bajo riesgo de recidiva: si tiene un PSA< 10ng/ml,
un Gleason de 2-6 y un T1 o T2A.
Esperanza de vida < 10 años monitorización o radioterapia (RT) Esperanza de vida > 10 años monitorización,
RT con o sin bloqueo hormonal ( 4-6 meses) o prostatectomía radical.
- De riego intermedio: si tiene un PSAentre10-20 ng/ml,
un Gleason de 7 o T2B o T2C.
Esperanza de vida < 10 años monitorización,
RT o cirugía.
Esperanza de vida > 10 años RT o RT con o sin bloqueo hormonal ( 4-6 meses) o prostatectomía radical
- De alto riesgo: si tiene un PSA >20 ng/ml,
un Gleason de 8-10 o T3A.
Bloqueo hormonal 2-3años y RT o RT con bloqueo hormonal 4-6 meses.
Prostatectomía radical para casos concretos.
- Localmente avanzado T3B oT4. Bloqueo hormonal 2-3 años y RT o RT con bloqueo hormonal 4-6 meses.
Prostatectomía radical para casos concretos.
- Metastásico: N1 con cualquier T.o M1 con cualquier T.
N1 con cualquier T: Bloqueo hormonal 2-3años y RT o RT con bloqueo hormonal 4-6 meses.
M1 con cualquier T :Bloqueo hormonal 2-3años.
Implicaciones en la planificación de radioterapia.
Los métodos de diagnóstico del tumor primario más ampliamente utilizados en el carcinoma de próstata son: el tacto rectal y la ecografía transrectal.
Ambas pruebas tienen una baja sensibilidad y especificidad,
lo cual puede suponer una incorrecta estadificación del carcinoma prostático y un planteamiento del tratamiento radioterápico poco adecuado.La RM3T tiene el potencial de incrementar la sensibilidad y la especificidad del diagnóstico del tumor primario,
que puede modificar el tratamiento de radioterapia.
La planificación de radioterapia se realiza habitualmente analizando el grupo de riesgo de recidiva,
basándose en los valores del PSA,
el score Gleason de la biopsia transrectal y la estadificación por ultrasonido o/y TAC.
La RM con la imagen de difusión identifica morfológica y funcionalmente el CP que conlleva a una modificación del T,
la mayoría de los T1c no visibles por ecografía se re-estadifican como T2 A o incluso T2B y T2C modificando así su grupo de riesgo.
Además permite valorar la extensión extracapsular e invasión de vesículas seminales que modifica la planificación y la dosimetría del tratamiento.Kajihara y colaboradores (25) señalan que el uso combinado de difusión e imagen potenciada en T2 incrementa la sensibilidad (de 26–51% a 47–72%) y el valor predictivo positivo (de 47–73% a 58–80%) en la localización del CP y sugieren que puede mejorar la planificación de radioterapia.
En nuestro centro la dosis total de RT empleada será de 78 Gy en pacientes de bajo riesgo y de 80 Gy en el resto de pacientes.
En los pacientes de riesgo intermedio y alto se incluyen las vesículas seminales en el campo de radiación.
Se utiliza un fraccionamiento de 2 Gy/sesión,
5 sesiones/ semana.
En pacientes con ganglios positivos se realizará irradiación de la pelvis utilizando técnica de boost simultáneo: 33 sesiones: Pelvis: 1.8 Gy/sesión,
59.4 Gy total .
Próstata + vesículas seminales y ganglios afectos: 72.6 Gy a 2.2 Gy / sesión.
Si existe redidiva bioquímica tras la cirugía y no se objetiva recidiva local con RM el paciente sería tratado con radioterapia utilizando70 Gy en el área de prostatectomía; por el contrario si la recidiva local es visualizada por RM se utilizaría 76 Gy en el área quirúrgica y en la recidiva local.
Monitorización de respuesta al tratamiento
El seguimento del CP tras prostatectomía radical,
radioterapia,
tratamiento hormonal,
ultrasonido focalizado de alta intensidad (HIFU) o crioablación es realizado periódicamente con medidas de PSA y tacto rectal.
El estudio de imagen hasta ahora se reservaba para aquellos casos con tacto tectal positivo,
elevaciones del PSA ( fallo bioquímico ) o pacientes sintomáticos con dolor pélvico.
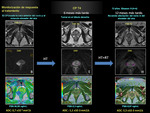
La difusión es una herramienta útil en la monitorización de los efectos terapeúticos del CP tras tratamiento radioterápico u hormonal.
Los cambios en los valores de ADC se correlacionan inversamente con la celularidad; la terapia anticáncer produce lisis tumoral,
pérdida de la integridad de las membranas celulares e incremento del espacio extraaxial que conlleva un aumento de los valores de ADC en el tumor.
Som I y colaboradores (26) señalan la utilidad del ADC,
en estudios realizados en 3T,
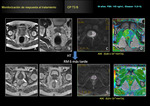
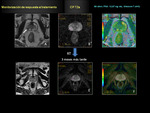
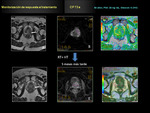
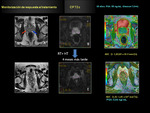
como biomarcador útil para la monitorización de la respuesta del CP al tratamiento radioterápico Fig. 18 Fig. 19 Fig. 20 Fig. 21 Fig. 22 .
Aquellos casos con escasa respuesta al tratamiento el ADC no se eleva de forma significativa con respecto al ADC previo tumoral pre-tratamiento.
Fig. 23
Detección de recurrencia local después de RT,
HT o prostatectomía radical.
La RM es capaz de identificar recidivas locales y sistémicas en pacientes con recidiva bioquímica después del primer tratamiento.
Recidiva bioquímica tras cirugía se define como dos elevaciones consecutivas del PSA >0.2 ng/ml separadas al menos por un mes.
El criterio Phoenix define fracaso bioquímico tras radioterapia como un incremento del PSA de 2 ng/mL o más sobre el nadir,
independientemente de si el paciente está recibiendo terapia hormonal o no (27).
Tras el tratamiento,
la próstata presenta marcada hiposeñal tanto en la zona periférica como central,
siendo difícil la valoración de recidiva.
Sin embargo,
en los casos recidiva,
la difusión mostrará diminución de los valores de ADC en la próstata tratada con radioterapia o/y hormonoterapia.
Kim y colaboradores (28) describen la utilidad de la utilización de imagen de difusión junto a la imagen T2 en un equipo 3T para detectar recidiva de CP tras radioterapia en 36 pacientes; la sensibilidad y especificidad de la imagen T2 versus Imagen T2 y difusión era 25% y 57% versus 62% y 91 % respectivamente (p< 0,05).
La media del valor de ADC en la recidiva fue 0.98 x 10−3 mm2/s mientras que en el tejido prostático benigno era de 1,60 x 10−3 mm2/s.
Fig. 24 Fig. 25 Fig. 26
El efecto rebote del PSA ocurre entre el 12% al 33% de los pacientes sometidos a irradiación externa,
con un tiempo medio de 9 meses,
presentando los pacientes una elevación sérica transitoria de los niveles del PSA que vuelven a la normalidad sin tratamiento en controles sucesivos (29).
El rebote del PSA no es predictor de fallo bioquímico y no debe emplearse como un indicador único de recidiva,
aunque sí es conocido que los pacientes que desarrollan múltiples oscilaciones del PSA tienen un mayor índice de recidivas (30).
La difusión ayuda a diferenciar el efecto rebote del PSA tras radioterapia de recurrencia local.
Algunos pacientes estudiados con RM con difusión durante el efecto rebote muestran áreas de descenso de ADC que se normalizan en controles sucesivos sin tratamiento.
En los casos de prostatectomía radical la difusión ayuda a establecer la presencia de recidiva local o/y redidiva a distancia (metástasis ganglionares o hematógenas).
La redidiva local tras la cirugía suele estar localizada próxima al cuello vesical o periuretral ;en los casos de cirugía reciente en esta localización podemos apreciar cambios inflamatorios- fibrosos postquirúrgicos que muestran valores altos de ADC.
En casos excepcionales el tejido de granulación postquirúrgico presenta valores bajos de ADC que pueden simular recidiva pero estos valores de ADC aumentarán en controles sucesivos sin tratamiento.
Fig. 27 Fig. 28 Fig. 29 Fig. 30
En adenopatías menores de 1 cm es recomendable el uso de PET-TEC con colina.
El uso de colina como marcador,
aunque en series pequeñas,
está ofreciendo resultados muy prometedores en la reestadificación del cáncer de próstata.
Recientemente,
aunque con un escaso volumen de pacientes,
Schmid y colaboradores (31) usaron 18 F-colina y equipo PET/TAC en la sospecha de recurrencia bioquímica,
incluso con cifras de PSA bajas (< 5 ng/ml),
con hallazgos tanto en el lecho prostático como a nivel ganglionar local y óseo.
Fig. 31
Limitaciones de la difusión en el diagnóstico del carcinoma prostático.
Existen varios procesos benignos que pueden producir disminución de los valores de ADC como prostatitis agudas,
hiperplasias prostáticas benignas con estroma fibromuscular denso (32,
33) o áreas de hemorragia (34) simulando CP Fig. 32 .
Otras limitaciones de esta secuencia incluyen artefactos de susceptibilidad por el gas rectal y los artefactos de movimiento de órganos vecinos (35).
Los tumores bien diferenciados con predominio glandular presenta valores más altos de ADC,
similar al tejido prostático normal (36).