La insuficiencia cardiaca se produce cuando hay un desequilibrio entre la capacidad del corazón para bombear sangre y las necesidades del organismo.
Es una enfermedad frecuente que se asocia con una significativa morbilidad y mortalidad,
lo que supone un alto coste para los servicios sanitarios.
El diagnóstico precoz y preciso junto con la valoración y estratificación del riesgo y la identificación de la causa subyacente es importante,
ya que algunas patologías pueden ser corregidas con un tratamiento específico.
La ecocardiografía ha sido la técnica de imagen más utilizada para identificar la causa de la insuficiencia cardíaca.
Sin embargo,
esta técnica está limitada por la ventana acústica en algunos pacientes y tiene una capacidad limitada para aportar información útil sobre la caracterización tisular específica.
Las principales cuestiones clínicas que necesitan una respuesta adecuada en un paciente con insuficiencia cardíaca incluyen:
- Definir de forma precisa el tamaño y la función ventricular
- Identificar la causa de la insuficiencia cardíaca
- Definir la viabilidad del miocardio
- Analizar la asincronía mecánica ventricular
- Excluir enfermedades del pericardio que potencialmente pueden simular insuficiencia cardíaca
La RM cardíaca puede responder a todas las cuestiones que son clínicamente relevantes en la insuficiencia cardíaca.
Presentamos iconográficamente los hallazgos claves en RM para el diagnóstico y valoración correcta de los pacientes con insuficiencia cardíaca.
VOLÚMENES Y FUNCIÓN SISTÓLICA VENTRICULAR
La insuficiencia cardíaca es un síndrome clínico habitualmente progresivo que con frecuencia comienza con disfunción sistólica del ventrículo izquierdo (VI).
La disfunción sistólica se produce por disminución de la contractilidad del miocardio o aumento de la postcarga del VI (Figs.
1 y 2)
- Disminución de la fracción de eyección (≤ 45%)
- Dilatación y remodelado ventricular con aumento del volumen telesistólico y telediastólico

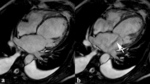
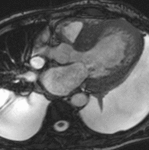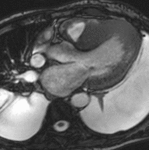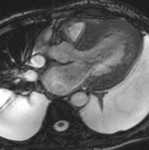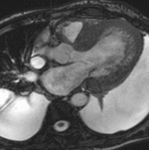
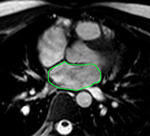
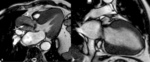
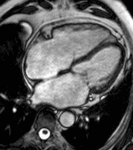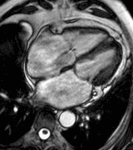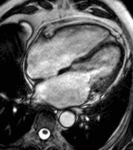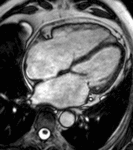
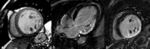
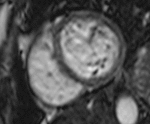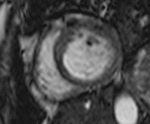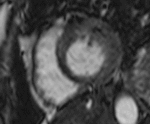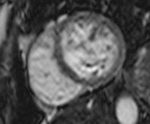
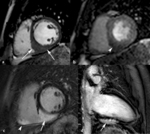
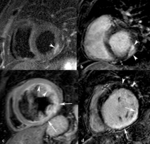
Fig. 1: Insuficiencia cardíaca sistólica. Las imágenes SSFP cine RM en el plano cuatro cámaras obtenidas en diástole (a) y sístole (b) muestran dilatación del VI con disfunción sistólica severa (fracción de eyección = 17%), flujo turbulento durante la sístole desde el VI hacia la aurícula izquierda (flecha) por insuficiencia mitral (fracción de regurgitación = 23%) y derrame pleural bilateral.
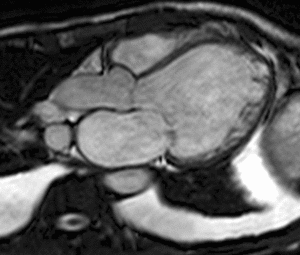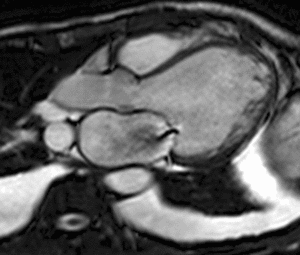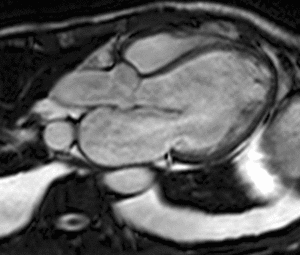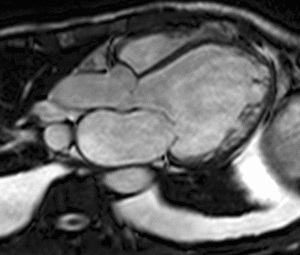
Fig. 2: Insuficiencia cardíaca sistólica. En el vídeo SSFP cine RM eje largo horizontal se demuestra la hipocinesia global del VI y las turbulencias de flujo por la insuficiencia mitral asociada. En la fase inicial de la disfunción sistólica, el ventrículo se hipertrofia, con el tiempo la función contráctil del miocardio hipertrófico se deteriora porque aumenta sus demandas metabólicas, el ventrículo se dilata, la fracción de eyección disminuye y se desencadena la descompensación.
La estratificación del riesgo y el tratamiento adecuado de los pacientes con insuficiencia cardíaca depende de la cuantificación exacta y reproducible de los volúmenes y de la función sistólica del VI.
El tamaño y la fracción de eyección del ventrículo izquierdo (FEVI) son necesarios para definir la indicación de
- La implantación de un desfibrilador cardíaco interno
- La terapia de resincronización cardíaca
- La sustitución de una válvula
- Fármacos específicos para la insuficiencia cardíaca
En la actualidad se considera que los volúmenes y la función del ventrículo derecho (VD) también se relacionan con la estratificación del riesgo de pacientes con insuficiencia cardiaca.
Las guías actuales de práctica clínica reconocen que la la RM cardíaca es la técnica de referencia para la cuantificación de los volúmenes,
función sistólica y masa de ambos ventrículos.
Esta cuantificación se obtiene con secuencias cine-RM de precesión libre en estado estacionario (SSFP) multicorte multifase.
Los volúmenes y la función del VI se obtienen en el plano eje corto desde la base hasta el ápex del VI (Fig.
3a).
La cuantificación del VD puede realizarse en el plano eje corto o de forma más precisa en plano axial desde la bifurcación pulmonar hasta la base del corazón (Fig.
3b).
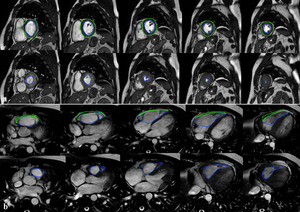
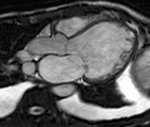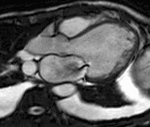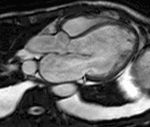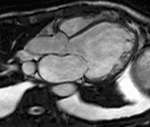
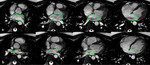
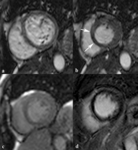
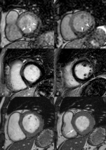
Fig. 3: (a) Las imágenes SSFP cine RM en plano eje corto desde la base hasta el ápex del VI muestran como calcular los volúmenes y la función del VI, dibujando el contorno endocárdico (azul) en las imágenes al final de la diástole y al final de la sístole Insuficiencia cardíaca sistólica y diastólica. La cuantificación de la masa del miocardio del VI se obtiene dibujando el contorno epicárdico (verde) en las imágenes telediastólica. (b) Imágenes SSFP cine RM en plano axial desde desde la bifurcación pulmonar hasta la base del corazón. La cuantificación de los volúmenes, función y masa del miocardio del VD se obtiene de forma similar al VI dibujando los contornos endocárdicos (azul) y epicárdicos (verde). El septo interventricular forma parte de la cuantificación de la masa del VI.
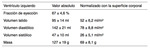
Los valores normales en adultos,
absolutos y normalizados con la superficie corporal,
de los volúmenes de ambos ventrículos en secuencias SSFP cine-RM se resumen en las Tablas I y II.
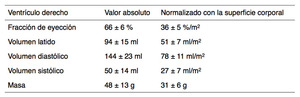
Table 1: Valores normales, absolutos y normalizados con la superficie corporal de los volúmenes y función del VD obtenidos con secuencias cine RM de precesión libre en estado estacionario (SSFP) multicorte multifase. (Maceira AM, Prasad SK, Khan M, Pennell DJ. Reference right ventricular systolic and diastolic function normalized to age, gender and body surface area from steady-state free precession cardiovascular magnetic resonance. Eur Heart J 2006; 27: 2879-2888).
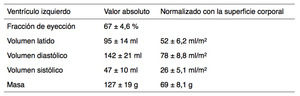
Table 2: Valores normales, absolutos y normalizados con la superficie corporal de los volúmenes y función del VI obtenidos con secuencias cine RM de precesión libre en estado estacionario (SSFP) multicorte multifase (Maceira AM, Prasad SK, Khan M, Pennell DJ. Normalized left ventricular systolic and diastolic function by steady state free precession cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2006; 8: 417-426).
ANÁLISIS DE LA FUNCIÓN DIASTÓLICA
La disfunción diastólica se produce por una alteración en la relajación miocárdica,
un aumento de la rigidez ventricular o por ambas (Figs.
4 y 5) y se caracteriza por
- Fracción de eyección normal o ligeramente reducida (50%)
- Aumento de las presiones de llenado diastólico
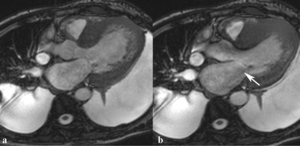
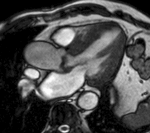
Fig. 4: Insuficiencia cardíaca diastólica en una miocardiopatía por depósito de amiloide. Imágenes SSFP cine RM eje largo horizontal en diástole (a) y sístole (b). Ventrículo izquierdo de tamaño normal con engrosamiento difuso del miocardio y fracción de eyección ligeramente disminuida (50%). Flujo turbulento en la aurícula izquierda durante la sístole (flecha) por insuficiencia mitral (fracción de regurgitación = 12%) y derrame pleural bilateral.
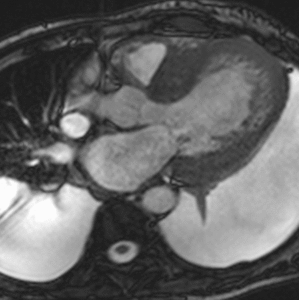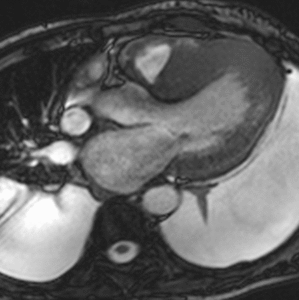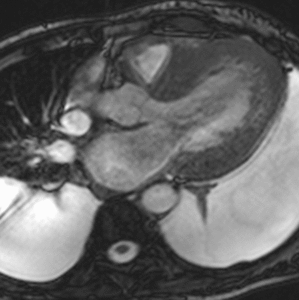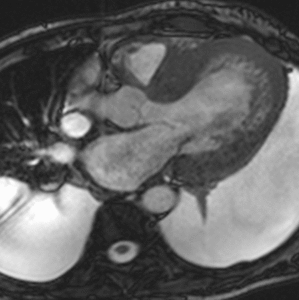
Fig. 5: Insuficiencia cardíaca diastólica en una miocardiopatía por depósito de amiloide. En el vídeo SSFP cine RM eje largo horizontal se demuestra la disminución de la distensibilidad del VI por fallo en la relajación del miocardio y las turbulencias de flujo por la insuficiencia mitral asociada.
En la mayoría de los pacientes con insuficiencia cardíaca,
existe disfunción sistólica y diastólica.
La ecocardiografía es la técnica de elección para el estudio no invasivo de la función diastólica.
Sin embargo,
el análisis de la relajación del miocardio y las alteraciones en la rigidez ventricular también puede obtenerse con RM analizando el tamaño y los volúmenes de la aurícula izquierda (AI) y el flujo a través de la válvula mitral y de las venas pulmonares.
Tamaño y volúmenes de la aurícula izquierda
Secuencia SSFP cine-RM en plano cuatro cámaras
- Planimetría del área de la aurícula izquierda (AI) (normal < 24 cm2) (Fig.
6)
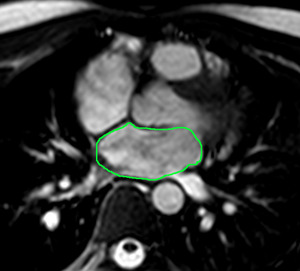
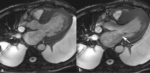
Fig. 6: Planimetría del área de la AI. La imagen axial SSFP cine RM en plano medio de la AI obtenida en la fase de mayor llenado auricular muestra como dibujar el contorno de la aurícula para obtener el área por planimetría.
Secuencia SSFP cine-RM multicorte multifase en plano axial o cuatro cámaras
- Volumen de la AI (normal: 97 ± 27 ml) (Fig.
7)
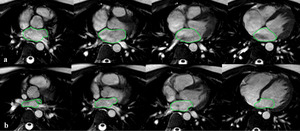
Fig. 7: Planimetría del área de la AI. La imagen axial SSFP cine RM en plano medio de la AI obtenida en la fase de mayor llenado auricular muestra como dibujar el contorno de la aurícula para obtener el área por planimetría.
La dilatación de la AI sugiere un aumento en la presión de llenado del VI y disfunción diastólica crónica.
La dilatación de la AI también puede asociarse con otras causas no relacionadas con la disfunción diastólica como la fibrilación auricular y la estenosis mitral.
En pacientes con disfunción diastólica,
la dilatación de la AI es un factor de mal pronóstico porque se asocia con mayor riesgo de eventos cardiovasculares.
Cuantificación del flujo transmitral
Secuencia cine-RM codificada con la velocidad en plano valvular mitral (velocidad codificada: 130 cm/seg)
- Se obtiene curvas velocidad/tiempo con una onda E (llenado rápido del VI al inicio de la diástole) y una onda A (llenado tardío del VI al final de la diástole y contracción de la AI) (Fig.
8)

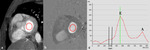
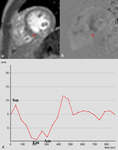
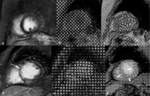
Fig. 8: Cuantificación del flujo transmitral. Las imágenes de magnitud (a) y fase (b) de la secuencia cine RM codificada (velocidad media =130 cm/s) en el plano valvular mitral muestran como dibujar el área de interés (ROI) para obtener la curva de velocidad/tiempo del flujo transmitral. (c) Curva velocidad/tiempo del flujo transmitral normal. Representa la capacidad de llenado del VI y se compone de una onda E y una onda A. La onda E refleja el llenado rápido del VI y la onda A, el llenado tardío al final de la diástole y el llenado por la contracción auricular. El tiempo de relajación isovolumétrica (TRIV) es el tiempo entre el cierre de la válvula aórtica y la apertura de la válvula mitral.
- El patrón de flujo transmitral permite clasificar a los pacientes en patrón de llenado normal (E < A),
en patrón de retraso de la relajación (E<< A),
y patrón restrictivo (E >> A) (Tabla III)

Table 3: Análisis de la función diastólica mediante la cuantificación de flujo en secuencias cine RM codificadas con la velocidad en el plano valvular mitral, venas pulmonares y miocardio del VI.
Cuantificación del flujo venoso pulmonar
Secuencia cine-RM codificada con la velocidad perpendicular a una vena pulmonar,
habitualmente la superior derecha,
1 cm por encima del ostium (velocidad codificada: 80-90 cm/seg)
- Se obtienen curvas velocidad/tiempo con una onda S (relajación de la AI y función sistólica del VI),
una onda D (inicio de la diástole) y una onda A (final diástole) (Fig.
9,
Tabla III)
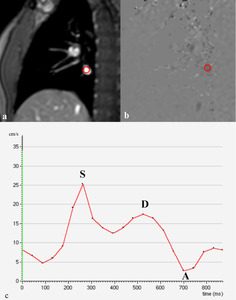
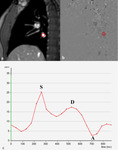
Fig. 9: Cuantificación del flujo venoso pulmonar. Las imágenes de magnitud (a) y fase (b) de la secuencia cine RM codificada (velocidad media = 80-90 cm/s) obtenidas en plano perpendicular a la vena pulmonar inferior derecha, 1 cm por encima del ostium, muestran como dibujar el área de interés (ROI) para obtener la curva de velocidad/tiempo del flujo venoso pulmonar. (c) Curva velocidad/tiempo del flujo venoso pulmonar. El flujo venoso pulmonar normal está formado por tres ondas, S, D y A. La onda S de llenado sistólico, representa el llenado de la AI durante la sístole ventricular. La onda D de llenado diastólico, representa una segunda fase de llenado durante la diástole ventricular. La onda A representa el flujo inverso hacia las venas pulmonares durante la contracción auricular.
La mayor utilidad de la cuantificación del flujo venoso pulmonar es diferenciar entre las curvas de flujo transmitral normal y seudonormal
- En la curva seudonormal,
la duración de la onda A es mucho mayor que la duración de la onda A del flujo transmitral.
Cuantificación de la velocidad de relajación del miocardio
Secuencia cine-RM codificada con la velocidad en eje corto,
algo más apical que el plano valvular mitral (velocidad codificada: 30 cm/seg)
- Se obtiene curvas velocidad/tiempo con una onda Sm (sistólica),
una onda Em (inicio de la diástole) y una onda Am (final diástole) (Fig.
10)
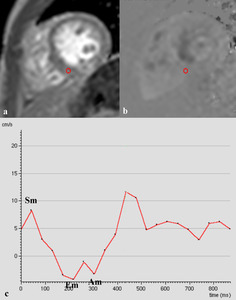
Fig. 10: Cuantificación de la velocidad de relajación del miocardio. Las imágenes de magnitud (a) y fase (b) de la secuencia cine RM codificada (velocidad media = 30 cm/s) obtenidas en plano eje corto en el tercio medio del VI, muestran como dibujar el área de interés (ROI) en el segmento inferoseptal de la base o tercio medio para obtener la curva de velocidad/tiempo de la relajación del miocardio (c) La curva está formada por una onda Sm sistólica y dos ondas diastólicas, una de relajación del VI (Em) y una segunda onda diastólica Am de contracción auricular.
- La presión de llenado del VI se obtiene de la relación entre la onda E del flujo transmitral y la onda Ea de la velocidad de relajación del miocardio (Tabla III)
- La presión de llenado del VI puede ser baja (E/Em < 8).
alta (E/Em > 15) o no concluyente (8< E/Em < 15)
La relación E/Em es el parámetro más preciso para estimar la presión de llenado del VI en ecocardiografía.
Su significado en RM todavía no se ha validado
IDENTIFICACIÓN DE LA ETIOLOGÍA
Una vez que el diagnóstico de insuficiencia cardíaca se establece y se identifica una alteración en la función ventricular,
el siguiente paso es definir su etiología.
Valvulopatías
El 10% de las insuficiencias cardíacas son de origen valvular.
Las valvulopatías mitral y aórtica son las que más frecuentemente se asocian con insuficiencia cardíaca.
Las estenosis suponen una sobrecarga de presión en la cavidad proximal a la estenosis.
El mecanismo de compensación es la hipertrofia concéntrica (Figs.
11 y 12)
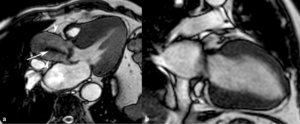
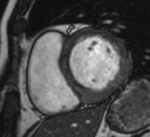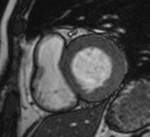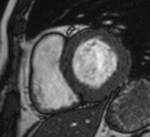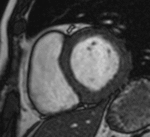
Fig. 11: Miocardiopatía hipertrófica difusa por estenosis valvular aórtica. Imágenes SSFP cine RM eje largo horizontal en sístole (a) y dos cámaras en diástole (b). Turbulencias de flujo (flecha) desde el plano valvular aórtico hacia la raíz aórtica dilatada (puntas de flechas) por estenosis valvular aórtica que provoca engrosamiento concéntrico y difuso del miocardio del VI. La cuantificación de la velocidad obtenida en secuencias codificadas con la velocidad fue de 533 cm/s.
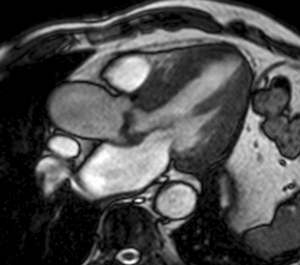
Fig. 12: Miocardiopatía hipertrófica difusa por estenosis valvular aórtica. El vídeo en eje largo horizontal muestra turbulencias de flujo por estenosis valvular aórtica, hipertrofia y disminución de la relajación del miocardio durante la diástole.
- Cuando la valvulopatía progresa y la capacidad contráctil del miocardio hipertrófico disminuye,
se desencadena la insuficiencia cardíaca
Las insuficiencias valvulares suponen una sobrecarga de volumen en la cámara que recibe el reflujo
- El mecanismo de compensación es la dilatación de la cavidad cardiaca proximal al aparato valvular que es insuficiente (Figs.
13 y 14)
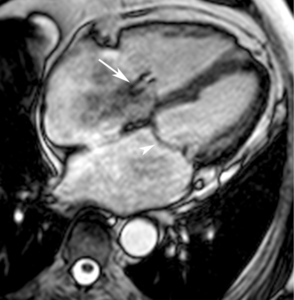
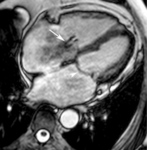
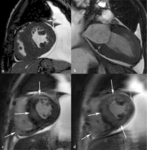
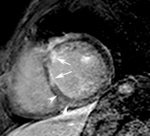
Fig. 13: Hombre de 67 años con disnea de mínimos esfuerzos, clase funcional III. La imagen cuatro cámaras SSFP cine RM en diástole demuestra un flujo turbulento hipointenso en la aurícula derecha por insuficiencia valvular tricúspide (flecha) secundaria a dilatación del ventrículo derecho, prolapso de la valva mitral anterior (punta de flecha y dilatación de la aurícula izquierda. La función sistólica de ambos ventrículos era normal.
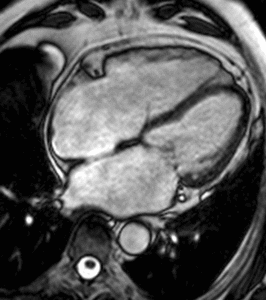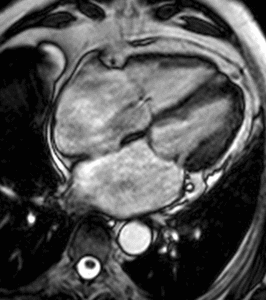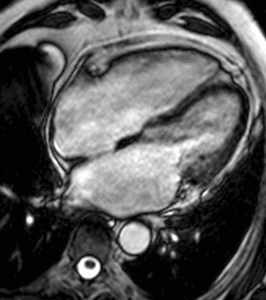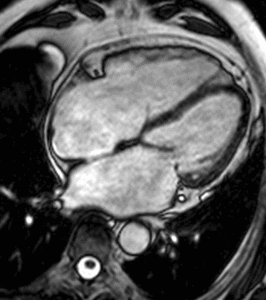
Fig. 14: Hombre de 67 años con disnea de mínimos esfuerzos, clase funcional III. El vídeo cuatro cámaras muestra la dilatación de ambas aurículas por insuficiencia de las válvulas atrioventriculares, el prolapso de la valva mitral anterior y dilatación del ventrículo derecho.
- Si la insuficiencia persiste,
se desencadena la insuficiencia cardíaca
Miocardiopatías
Diferenciar entre miocardiopatía isquémica (MCI) y no isquémica e identificar la etiología de la miocardiopatía no isquémica es fundamental porque el tratamiento y pronóstico de los pacientes es diferente.
Secuencias de miocardio negro
Las secuencias de miocardio obtenidas a los 5 minutos de la administración intravenosa de gadolinio quelado sirven para definir las áreas en las que existe daño en la integridad de la membrana celular por necrosis,
inflamación o fibrosis,
en las que el gadolinio se acumula en el espacio intersticial.
El análisis de la extensión y distribución del realce tardío puede diferenciar la disfunción del VI por MCI de las miocardiopatías no isquémicas (Tabla IV)

Table 4: Principales tipos de realce tardío del miocardio en las miocardiopatías.
Miocardiopatía isquémica (Fig.
15)
- El realce tardío siempre afecta al subendocardio
- La localización es en el territorio de las arterias coronarias
- Puede ser transmural,
dependiendo de la extensión de la necrosis
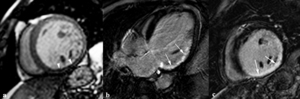
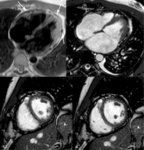
Fig. 15: Miocardiopatía isquémica en un hombre de 50 años con dilatación y disfunción sistólica del VI (FE = 40%). Las imágenes de perfusión de primer paso tras administración de contraste intravenoso (a, b) muestran una hipoperfusión subendocárdica (puntas de flechas) en el segmento inferior e inferolateral del tercio medio (punta de flecha). Las imágenes de miocardio negro en eje largo horizontal (c) y eje corto (d) demuestran realce tardío subendocárdico y realce transmural (flechas) en los segmentos irrigados por la arteria coronaria derecha y circunfleja.
En el 15% de pacientes con MCI documentada por cateterismo,
el realce tardío puede estar ausente o no tener una distribución coronaria
- Miocardiopatía isquémica sin necrosis miocárdica y disfunción del VI por miocardiopatía no isquémica asociada
- Presencia de colaterales
- Disfunción sistólica del VI por episodios repetidos de miocardio aturdido (alteración transitoria de la motilidad por episodios isquémicos Figs.
16 y 17) o hibernado (hipoperfusión persistente sin necrosis Figs.
18 y 19)
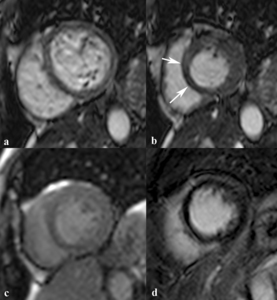
Fig. 16: Miocardio aturdido en un mujer de 52 años tras revascularización coronaria. Las imágenes diastólica (a) y sistólica (b) SSFP cine RM en plano eje corto muestran una acinesia del septo interventricular (flechas) durante la sístole. En las imágenes de primer paso (C) y de miocardio negro (d) se ve que el septo interventricular está bien perfundido y es viable.
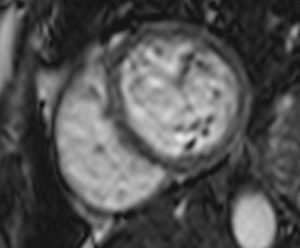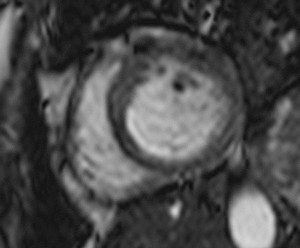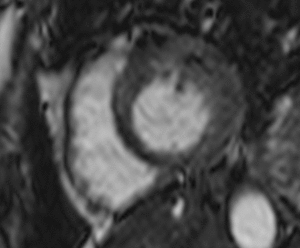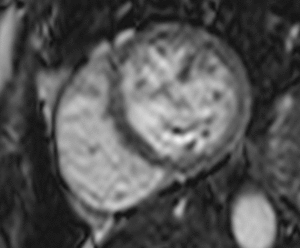
Fig. 17: Miocardio aturdido en un mujer de 52 años tras revascularización coronaria. El vídeo en eje corto muestra la acinesia del septo interventricular durante la sístole.
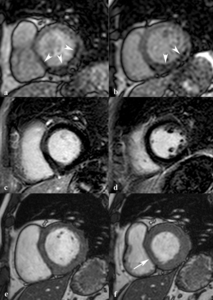
Fig. 18: Miocardio hibernado en un hombre de 55 años con parada cardiorespiratoria por ritmo desfibrilable, disfunción sistólica del VI (FE = 47%) y con ateromatosis coronaria sin estenosis significativas en la coronariografía. Imágenes de perfusión de primer paso (a, b), miocardio negro (c, d) y SSFP cine RM en diástole (e) y sístole (f). Hipocinesia de los segmentos inferior e inferoseptal de la base (flecha), asociada con hipoperfusión subendocárdica (puntas de flechas) en los segmentos inferoseptal, inferior e inferolateral de la base e inferior e inferolateral del tercio medio, con preservación de la viabilidad miocárdica (c, d).
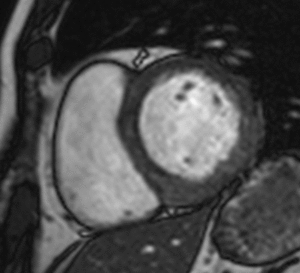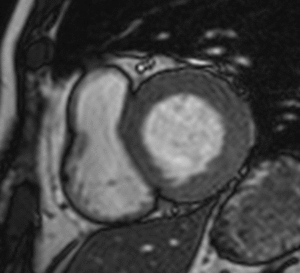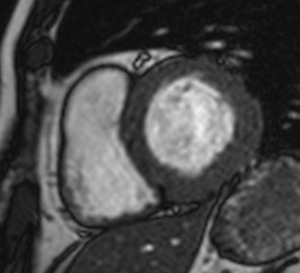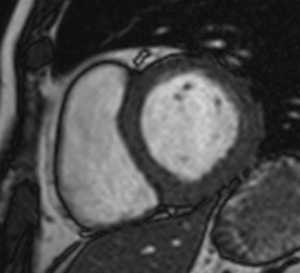
Fig. 19: Miocardio hibernado en un hombre de 61 años con parada cardiorespiratoria por ritmo desfibrilable, disfunción sistólica del VI (FE = 47%) y con aterotamosis coronaria sin estenosis significativas en la coronariografía. El vídeo en eje corto demuestra la hipocinesia de los segmentos inferior e inferolateral de la base.
Miocardiopatía no isquémica (Fig.
20)
- El realce tardío no tiene distribución subendocárdica
- No tiene una distribución coronaria
- Puede ser mesocárdico,
epicárdico o endocárdico global,
dependiendo de la extensión de la fibrosis
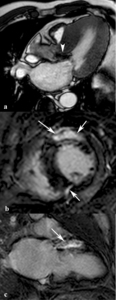
Fig. 20: Imagen eje largo horizontal SSFP cine RM en sístole de una miocardiopatía hipertrófica difusa con turbulencias de flujo en el tracto de salida del VI (punta de flecha) por obstrucción dinámica. Las imágenes de miocardio negro en planos eje corto (b) y dos cámaras (c) demuestran realce tardío (flechas) mesocárdico en los segmentos anteriores del tercio medio y de la base y en la unión del miocardio del VI y del VD en el tercio medio. La cuantificación el flujo en el tracto de salida del VI mediante secuencias cine RM codificadas con la velocidad demostró una velocidad pico de 200 cm/s.
Algunos patrones de realce tardío son específicos y permiten definir el pronóstico de algunas miocardiopatías no isquémicas
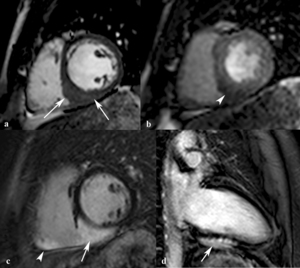
Fig. 21: Hombre de 29 años con sarcoidosis pulmonar, dolor torácico, taquicardia ventricular , disfunción sistólica del VI y coronariografía normal. La imagen eje corto SSFP cine RM en diástole demuestra un engrosamiento focal de los segmentos inferoseptal e inferior del tercio medio (flechas). Las imágenes de perfusión de primer paso en el tercio medio del VI (b) y de miocardio negro en eje corto (c) y dos cámaras (d) muestran hipoperfusión subepicárdica en el segmento inferoseptal del tercio medio (punta de flecha) y realce tardío subepicárdico en los segmentos inferoseptal e inferior del tercio medio (flechas) y en el miocardio del VD (punta de flecha). El estudio histológico de la biopsia transbronquial y endomiocárdica demostró granulomas no necrotizantes compatibles con sarcoidosis.
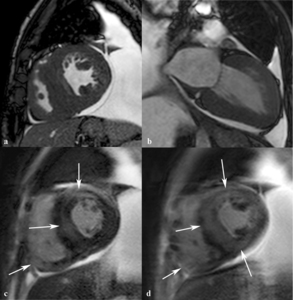
Fig. 22: Amilodosis cardíaca en un paciente diagnosticado de miocardiopatía hipertrófica e insuficiencia cardíaca. Imágenes diastólicas SSFP cine RM en eje corto (a) y dos cámaras (b). Engrosamiento difuso del miocardio de ambos ventrículos, derrame pleural y pericárdico. Las imágenes de miocardio negro en eje corto (c, d) demuestran realce tardío intramiocárdico parcheado (flechas) en ambos ventrículos. La fracción de eyección del VI estaba ligeramente deprimida (FE = 50%). La biopsia endomiocárdica confirmó el diagnóstico de miocardiopatía hipertrófica por depósito de amiloide.
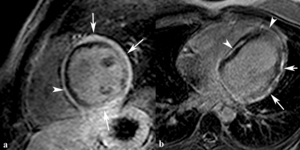
Fig. 23: Miocarditis en un hombre de 25 años con dolor torácico, elevación del ST en el electrocardiograma y coronariografía normal. Las imágenes de miocardio negro en el plano eje corto (a) y cuatro cámaras (b) muestran realce subepicárdico (flechas) en los segmentos del tercio medio y de la base y realce mesocárdico parcheado (puntas de flechas) compatible con miocarditis. La cuantificación de la función ventricular en secuencias SSFP cine RM demostró disfunción sistólica del VI con una fracción de eyección de 40%.
- Miocardiopatía no compactada (Fig.
24)
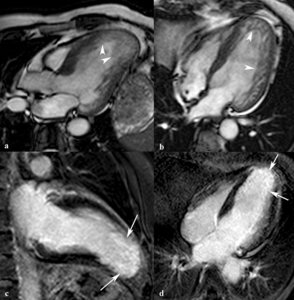
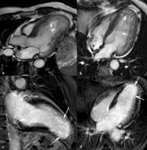
Fig. 24: Miocardiopatía no compactada. Imágenes SSFP cine RM en eje largo horizontal (a) y cuatro cámaras durante la diástole. Trabeculación del miocardio del VI en los segmentos apicales y laterales del tercio medio y de la base. La longitud mayor de las trabéculas es de 50 mm y el grosor del miocardio subyacente en diástole de 5 mm. En las imágenes de miocardio negro dos cámaras (c) y eje largo horizontal (d) se ve el realce difuso de las trabeculaciones del miocardio (flechas) en los segmentos apicales.
Secuencias T2*
El depósito de hierro en el miocardio puede ser secundario a transfusiones múltiples o a hemocromatosis primarias (Fig.
25).
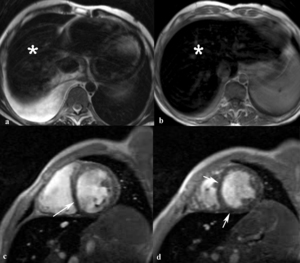
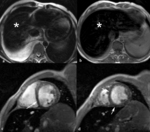
Fig. 25: Hombre de 29 años con cirrosis secundaria a hemocromatosis juvenil e insuficiencia cardíaca. Las imágenes axiales TSE-T2 (a, b) muestran la hiposeñal del parénquima hepático (asteriscos) por el depósito de hierro y derrame pleural derecho. En las imágenes TEG-T2* cine RM eje corto en diástole se ve dilatación de ambos ventrículos y la hiposeñal del miocardio (flechas) y del parénquima hepático.
La sobrecarga de hierro en el miocardio puede valorarse de manera cuantitativa mediante secuencias T2* (T2* normal,
40 ms)
- Puede detectarse la enfermedad antes de que aparezcan síntomas de insuficiencia cardíaca (T2* entre 20 y 40 ms)
- La mayoría de los pacientes con insuficiencia cardíaca presentan un T2* miocárdico de < 20 ms
- La miocardiopatía por depósito de hierro puede ser reversible si se inicia el tratamiento quelante de forma precoz
Secuencias TSE-T2 o STIR
Las secuencias TSE-T2 o STIR identifican el edema de miocardio
Diagnóstico de miocarditis
- Aumentan la precisión diagnóstica cuando se adquieren además de las secuencias de miocardio negro (Figs.
26a y 26b)
Diferencian entre infarto de miocardio agudo y crónico (Figs.
26c y 26d)
- Pueden detectar edema que supera en tamaño al área de realce tardío por necrosis
- El edema representa el área de miocardio en riesgo,
no infartado
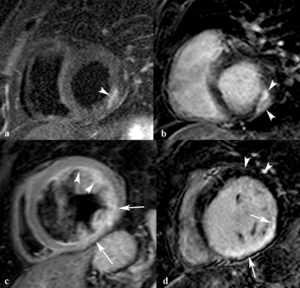
Fig. 26: Imágenes STIR y de miocardio negro en eje corto en una miocarditis (a, b) y en un infarto de miocardio reciente (c, d). En la miocarditis se ve que el edema del miocardio (punta de flecha) se correlaciona con el área de realce subepicárdico y mesocárdico (puntas de flechas). En el infarto agudo de miocardio, la hiperseñal de los segmentos inferior e inferolateral del tercio medio (flechas) se correlaciona con el realce transmural en el segmento inferior y realce subendocárdico en el segmento anterolateral en la imagen de miocardio negro (flechas), Se ven áreas de hiperseñal en los segmentos anterior y anterolateral (puntas de flechas) en la imagen STIR que corresponden con miocardio viable (puntas de flechas).
Ayudan al diagnóstico del rechazo agudo en pacientes con trasplante cardíaco.
ANÁLISIS DE LA VIABILIDAD
La revascularización de miocardio viable mejora de la función del VI,
los síntomas de insuficiencia cardíaca,
y la supervivencia.
Selección de pacientes candidatos a revascularización
La identificación de miocardio viable es uno de los factores más importantes para seleccionar los pacientes candidatos y orientar los procedimientos de revascularización miocárdica en pacientes con MCI y disfunción crónica del VI
La extensión del realce transmural es inversamente proporcional a las posibilidades de recuperación funcional del VI tras la revascularización miocárdica (Fig.
15,
Tabla V)
- La mayor tasa de recuperación funcional se consigue en pacientes con miocardio viable o realce transmural < 25%
- Cuando el realce transmural es de 25-75%,
la recuperación funcional es más variable
- La recuperación funcional es solo de 1-3% en pacientes con realce transmural > 75%

Table 5: Relación entre la extensión del realce transmural del miocardio y la probabilidad de recuperación funcional tras un infarto agudo de miocardio.
Además de la extensión del realce tardío,
es necesario un mínimo grosor del miocardio viable para la recuperación funcional del VI tras revascularización
Obstrucción microvascular
Fallo en la reperfusión del miocardio en el centro del infarto agudo
- Compresión de los capilares por edema del miocardio
- Oclusión capilar por microtrombos
- Necrosis capilar
La combinación de secuencias de primer paso y de miocardio negro identifica la obstrucción microvascular del infarto agudo (Fig.
27)
- Defecto de perfusión en el miocardio no perfundido
- Miocardio viable hipointenso rodeado de un área de realce tardío
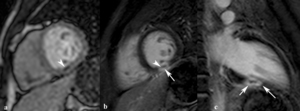
Fig. 27: Obstrucción microvascular. Hombre de 32 años con vasculitis cerebral, tromboembolismo pulmonar crónico, clínica de infarto agudo de miocardio inferior y coronariografía normal. (a) La imagen de perfusión de primer paso en eje corto muestra una hipoperfusión subendocárdica (punta de flecha) en el segmentos inferior del tercio medio. En las imágenes de miocardio negro en eje corto (b) y dos cámaras (c) se ve el miocardio viable hipointenso (punta de flecha) rodeado de un área de realce tardío (flechas) por fallo en la reperfusión del miocardio en el centro del infarto agudo.
La identificación en RM de obstrucción microvascular en el infarto agudo
- Predictor del remodelado y del deterioro de la función del VI ,
independiente de la extensión de la necrosis
- Mayor probabilidad de eventos cardiovasculares
Reserva contráctil
El análisis de la reserva contráctil puede ayudar a predecir la recuperación funcional en pacientes con extensión del realce transmural entre 50 y 75%.
La reserva contráctil puede analizarse cuantificando las áreas de hipoperfusión del miocardio en secuencias de perfusión de primer paso obtenidas con dosis bajas de adenosina o dobutamina
ANÁLISIS DE LA ASINCRONÍA MECÁNICA VENTRICULAR
Tratamiento de resincronización cardíaca
La terapia de resincronización cardíaca consiste en la implantación de un marcapasos por vía venosa con la capacidad de estimular la AD,
el VD y el VI.
Es una opción terapéutica nueva que puede mejorar los síntomas y el pronóstico en pacientes con insuficiencia cardíaca severa y disincronía inter o intraventricular.
La respuesta al tratamiento de resincronización cardíaca depende de la severidad de la disincronía,
la extensión de la necrosis del miocardio y la relación entre la localización de la necrosis y el sitio de la implantación del electrodo en el VI
Severidad de la disincronía
Secuencias de marcaje del miocardio (tagging)
- Análisis de la deformidad segmentaria de la rejilla durante la sístole (Fig.
28)
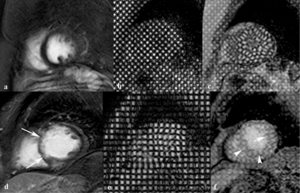
Fig. 28: Análisis de la deformidad segmentaria del miocardio. Las imágenes de miocardio negro (a) y cine RM con marcaje del miocardio (tagging) obtenidas en diástole (b) y sístole (c) en el tercio medio del VI en un paciente con extrasístoles demuestran la señal normal del miocardio viable, la cuadrícula de la rejilla en reposo durante la diástole (b) y la deformidad simétrica de la rejilla hacia el centro del VI durante la sístole (c). En un paciente con necrosis transmural del miocardio por infarto (fechas) (d) se ve la cuadrícula de la rejilla en diástole (e), la deformidad de la rejilla hacia el centro de la cavidad del VI de los segmentos laterales (flecha) de miocardio y la menor deformidad en los segmentos inferior y septal (puntas de flechas) durante la sístole (f).
Secuencias cine-RM codificadas con la velocidad
- Cuantificación de la velocidad de relajación del miocardio (Fig.
10)
Extensión de la necrosis del miocardio
Secuencias de miocardio negro
- Identificación de áreas de realce tardío (Fig.
15)
Implantación de un desfibrilador cardíaco interno automático (DAI)
La implantación de un DAI es el tratamiento de elección en pacientes con alto riesgo de muerte súbita.
La selección de los pacientes se basa fundamentalmente en la FE del VI.
En el infarto de miocardio se distingue una zona central de tejido cicatricial y una zona periférica que rodea a la necrosis.
Esta zona periférica está constituida por fibrosis y miocardio viable y es el sustrato morfológico de la taquicardia ventricular de re-entrada después de un infarto de miocardio.
La cuantificación de la zona peri-infarto puede ser útil para la estratificación del riesgo y para la selección de pacientes candidatos a un DAI después de un infarto de miocardio.
Las secuencias de miocardio negro pueden utilizarse para cuantificar la zona peri-infarto (Fig.
29)
Zona central de infarto de miocardio
Zona peri-infarto
- Señal intermedia por retención del contraste en la zona de fibrosis y lavado en el miocardio viable
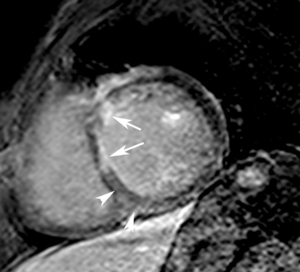
Fig. 29: Infarto de miocardio en un hombre de 75 años. La imagen de miocardio negro en eje corto demuestra realce tardío subendocárdico intenso (flechas) en el segmento anteroseptal del tercio medio, realce tardío menos intenso en el segmento inferoseptal (puntas de flechas) e hiposeñal normal del miocardio viable en los segmentos anterior, lateral e inferior.
EXCLUSIÓN DE ENFERMEDADES DEL PERICARDIO
El diagnóstico diferencial entre miocardiopatía restrictiva y pericarditis constrictiva es fundamental porque su tratamiento y pronóstico son diferentes.
En ambas entidades existe una restricción al llenado ventricular lo que provoca
- Morfología tubular de los ventrículos (especialmente el derecho)
- Dilatación de una o ambas aurículas
- Dilatación de vena cava inferior y venas hepáticas
- Disminución del volumen telediastólico y de la fracción de eyección
- Trastornos de la motilidad
Criterios diagnósticos de pericarditis constrictiva (Fig.
30) que permiten diferenciarla de las miocardiopatías restrictivas
Secuencias SE EPI T1
- Engrosamiento focal o difuso del pericardio (≥ 4 mm)
Secuencias SSFP cine-RM
- Aplanamiento o abombamiento paradójico del septo interventricular durante el inicio de la diástole ventricular
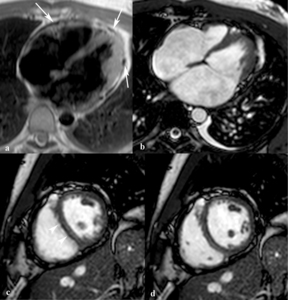
Fig. 30: Pericarditis constrictiva. Las imágenes cuatro cámaras TSE EPI (a), y SSFP cine RM (b) muestran un engrosamiento difuso y segmentario del pericardio (flechas), dilatación de ambas aurículas y la morfología tubular de ambos ventrículos. En las imágenes SSFP cine RM en eje corto obtenidas al inicio (c) y al final (d) de la diástole se ve el aplanamiento del septo interventricular (puntas de flechas) durante el inicio de la diástole que recupera su posición normal al final de la diástole.
Secuencias SSFP cine-RM y de marcaje del miocardio (tagging) cuando el pericardio es de grosor normal
- Adherencias entre el pericardio visceral y parietal