RECUERDO ANATÓMICO
Circulación hepática:
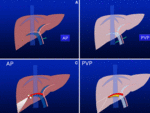
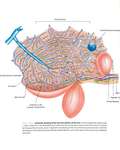
El hígado es un organo con doble aporte vascular desde la arteria hepática y vena porta y una única vía de salida,
las venas hepáticas.
Durante la fase arterial hepática en una TAC dinámica multifásica tras la administración de contraste intravenoso,
el contraste alcanza el hígado vía arteria hepática,
que supone el 25% del aporte sanguíneo total,
mientras que la mayoría,
el 75%,
procedente de la vena porta aún no está opacificado.
Durante la fase venosa portal,
no sólo se opacifica el sistema portal sino también el sistema arterial consiguiendo una opacificación del 100% del parénquima hepático.
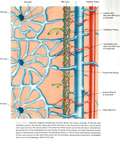
Las vénulas portales y arteriolas hepáticas fluyen por separado hacia el sinusoide hepático comunicándose por el plexo peribiliar.
Durante la fase de equilibrio la concentración de contraste se equipara y la diferencia de captación debida a los shunts se vuelve menos pronunciado.
1) Cambios en el INFLOW venoso portal
Shunt arterio-portales:
La visualización de estas anomalías de perfusión depende del volumen y del flujo con el que se administra el contraste intravenoso asi como del tiempo de adquisión de la imagen.
Por su naturaleza,
los shunt arterioportales se ven con más claridad durante la fase arterial tardía (35 sg aprox) y con una tasa de infusión de contraste de 3-5 mL/sg.
Los shunt arterio-portales son comunicaciones entre el sistema arterial y portal hepático resultando en una redistribución del flujo arterial hacia una región focal del flujo venoso portal.
Esta redistribución del flujo ocurre cuando existe una disminución de flujo portal que hace que, de forma compensatoria,
aumente el flujo arterial hepático regional o cuando de forma directa aumenta la perfusión arterial.
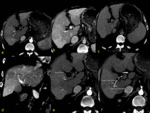
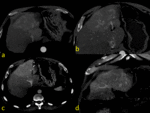
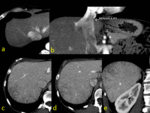
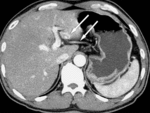
Fig. 1
Mientras que en condiciones normales la suma del flujo arterial y portal hepático se mantiene constante por mecanismos compensatorios,
en este caso el aumento de la fracción arterial regional produce un aumento de gradiente de presión produciendo shunts hacia venas portales tributarias.
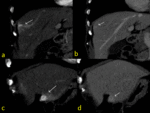
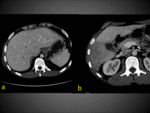
La región hipercaptante focal contrasta con el resto de parénquima mínimamente captante siendo una causa común de las diferencias de atenuación hepática transitorias (DAHT) que nos encontramos en la fase arterial.
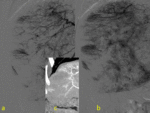
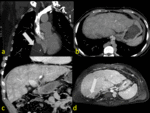
En la DHAT se observa un área de hiperatenuación homogénea con o sin opacificación temprana de rama portal en fase arterial sin que exista opacificación de la vena porta principal. En fase portal puede ser iso o ligeramente hiperatenuante por el efecto del aporte arterial pero NUNCA existirá LAVADO.
Fig. 2
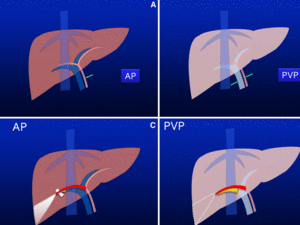
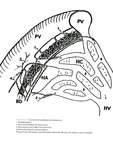
Fig. 2: Diagrama de un hígado con DAHT. a) Durante la fase arterial el hígado capta ligeramente por el contraste que le llega desde la arteria hepática que supone un 25% del aporte total. b) Durante la fase venosa portal alcanza el máximo realce a través del aporte procedente de la vena porta mientras que se mantiene también la afluencia desde la arteria hepática. c,d) Cuando existe una disminución del flujo venoso portal, el flujo arterial regional aumenta compensatoriamente. Aunque la suma del aporte arterial y portal se mantiene constante (triangulo con rallas discontinuas en d) como el resto del hígado. La región hipercaptante (triangulo blanco en c) debida a la fracción arterial aumentada se observa bien contrastada respecto al resto del parénquima mínimamente captante durante la fase arterial, produciendo el fenómeno de DAHT.
References: Hyun-Jung Jang, Korosh Khalili, Hojun Yu, Tae Kyoung Kim Perfusion and parenchymal changes related to vascular alterations of the liver Abdom Imaging (2011) DOI: 10.1007/s00261-011-9767-0
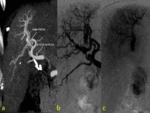
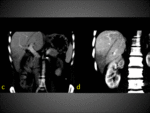
El sistema transplexal (plexo peribiliar) es el sistema regulador más importante entre arteria hepática y vena porta pero existen otras vías comunicantes a nivel microscópico: transinusoidal,
transvasal (v.vasorum de la pared de la pared de v.porta) ,
transtumoral (si un tumor tiene suplencia de arteria hepática y utiliza la vena porta como drenaje).Fig. 3 Fig. 4 Fig. 5
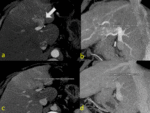
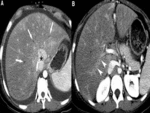
Las DHAT también se pueden ver a nivel en caso de fístulas arterioportales macroscópicas cuya causa más frecuente es la traumática (frecuentemente la biopsia).
Las fístulas arterioportales transtumorales pueden asociarse a neoplasias malignas hipervasculares o a hemangiomas.
En el pasado la asociación de lesiones con shunt arterioportales era signo de malignidad.
Sin embargo,
en las lesiones pequeñas la intensidad de shunt arterioportal es mucho mayor en hemangiomas que en CHC estando estrechamente asociado a hemangiomas de llenado rápido.
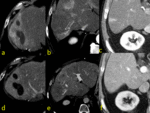
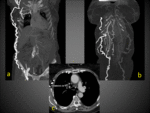
Fig. 6 Fig. 7
Anomalías de perfusión no-tumoral vs tumoral en el hígado cirrótico:
Diferenciar anomalías de perfusión no tumorales de tumorales es un punto crítico especialmente en el hígado cirrótico.
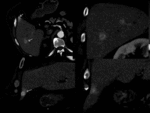
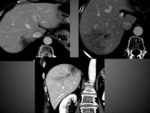
Los pequeños shunt arterioportales no-tumorales son muy frecuentes en el hígado cirrótico y es la causa más frecuente de los falsos positivos en TAC y RM.
Son típicamente de morfología en cuña,
localización subcapsular y pueden mostrar un reflujo a una rama venosa portal.
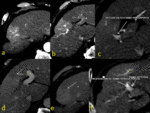
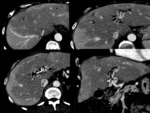
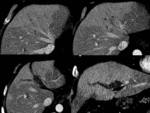
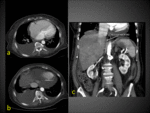
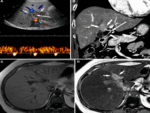
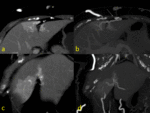
Fig. 8 Fig. 9 Fig. 10Fig. 11 Fig. 12 Fig. 13 Fig. 14
Estos shunt arterioportales pueden semejar una morfología nodular dependiendo del plano del TC y llevarnos a error por lo es de gran ayuda correlacionarlos en planos ortogonales.
Fig. 15
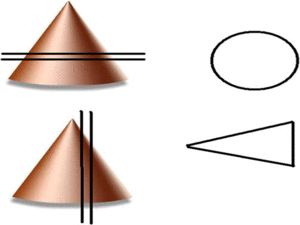
Fig. 15: Dependiendo de la orientación relativa de los shunt arterioportales tendrán una apariencia redonda o "en cuña"
References: Hyun-Jung Jang, Korosh Khalili, Hojun Yu, Tae Kyoung Kim Perfusion and parenchymal changes related to vascular alterations of the liver Abdom Imaging (2011) DOI: 10.1007/s00261-011-9767-0
Los DHAT de los shunt arterioportales no-tumorales serán homogéneos en fase arterial sin lavado en fase tardía,
mientras que en los CHC,
serán más heterogéneos y típicamente con lavado.
A menudo el lavado del CHC es tardío por lo que será importante realizar adquisiciones tardías para su diferenciación.
La apariencia de estos shunt arterioportales en TC de control puede variar desde su resolución,
disminución de tamaño,
estabilización e incluso hasta el aumento de tamaño.
La mayoría de los focos hipercaptantes < 2 cm visualizados en fase arterial en hígados cirróticos son informados como no CHC en un 72-93% y los CHC en estos focos tienden a crecer lentamente.
No obstante los CHC recurrentes que se manifiestan como múltiples micromódulos hiperatenuantes pueden ser muy agresivos por lo que estaría justificada una monitorización estrecha.
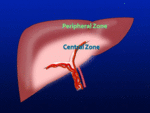
Perfusión zonal:
Cuando existe una obstrucción crónica de la vena porta principal el aporte esplácnico forma redes colaterales llamadas cavernomatosis portal.
En la zona central perihiliar el flujo rico en grasas procedente del territorio intestinal está relativamente preservado,
vía colaterales hiliares,
por lo que esta zona presentará una hipertrofia junto con cambios esteatósicos.
Por otra parte,
las zonas periféricas,
reciben el aporte portal disminuido observándose una hiperperfusión arterial compensatoria con atrofia y preservación grasa Fig. 17 .
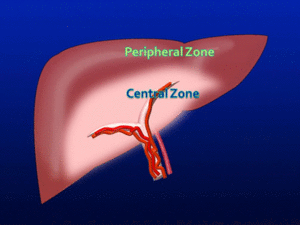
Fig. 16: Diagrama del fenómeno "perfusión zonal".
References: Hyun-Jung Jang, Korosh Khalili, Hojun Yu, Tae Kyoung Kim Perfusion and parenchymal changes related to vascular alterations of the liver Abdom Imaging (2011) DOI: 10.1007/s00261-011-9767-0
2) Cambios en el OUTFLOW venoso portal
Cambios de perfusión por obstrucción venosa aguda:
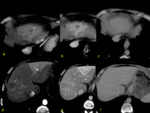
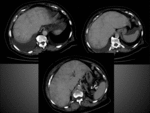
En la obstrucción venosa aguda existirá un aumento de la presión sinusoidal hasta que supera la presión venosa portal combirtiéndose esta última en una vena de drenaje. Como respuesta a la disminución del flujo portal aumentará la perfusión arterial y así los SAP.
La apariencia de una oclusión venosa aguda de la vena hepática en TAC: arterioportografía habrá un defecto de perfusión y una hiperperfusión compensatoria en la TAC arteriografía (como en la oclusión portal).
Diferencias: en la obstrucción de la v.hepática el borde del cambio de perfusión está intersectado por la v porta y viceversa; además,
en la obstrucción de la vena hepática el vertex del cambio es hacia la vena cava Fig. 18 Fig. 19 Fig. 20 y en la obstrucción portal hacia el hilio hepático Fig. 21 Fig. 22 Fig. 23 .
Las manifestaciones de la oclusión de la vena hepática aguda en la TAC multifásica son diferentes: se observará una hipoatenuación en FVP del segmento obstruido Fig. 18 Fig. 19 Fig. 20 con una hipercaptación arterial transitoria que será visible dependiendo del tiempo.
Esto es una diferencia respecto a la obstrucción portal que raras veces produce una hipoatenuación Fig. 21 Fig. 22 en FVP.
En fases tardías el segmento obstruido puede ser ligeramente hiperatenuante por el estancamiento del contraste.
El segmento adyacente al patológico puede se hiperatenuante en la FVP por un aporte portal adicional drenado desde el segmento congestivo.
Congestión venosa hepática post-trasplante:
La detección por imagen de la congestión venosa segmentaria es importante en injertos de LHD.
La congestión del segmento anterior ocurre en injertos de LHD que no incluyen vena hepática media o en estenosis de venas reconstruidas y del sector posterior en caso de ligadura de vena hepática inferior o estenosis anastomóticas.
La apariencia es variable dependiendo de la severidad y duración:
El sector congestionado será iso/ligeramente hipoatenuante en FA y en fase portal la apariencia se correlacionará con los índices clínicos: será hiperatenuante cuando existirá una recuperación sin atrofia y hipoatenuante cuando exista aumento de bilirrubina y atrofia posterior.
La congestión tiende a mejorar espontáneamente por formación de colaterales vensosas intrahepáticas.
Congestión hepática pasiva:
Es una condición de drenaje hepático dañado secundario a una causa cardiaca.
Puede ser desde subclínico hasta producir una cirrosis cardiaca.
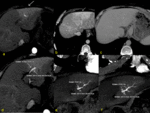
Hallazgos en TAC: cardiomegalia,
hepatomegalia,
captación reticular-moteada más pronunciada en la periferia por el estancamiento de contraste.
Como clave para el diagnóstico diferencial con el síndrome de Budd Chiari en la congestión hepática pasiva habrá aumento de tamaño de venas hepáticas y VCI.
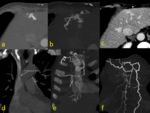
Fig. 24 Fig. 25 Fig. 26
Síndrome de Budd-Chiari:
Manifestación clínica de la obstrucción venosa hepática a cualquier nivel (excluyendo el síndrome de obstrucción sinusoidal y la congestión pasiva) a pesar de cual sea la causa por lo que constituye un grupo muy heterogéneo.
En occidente el SBC significa oclusión venosa hepática por diversas coagulopatías mientras que en Oriente y Sudáfrica se refiere a la obstrucción membranosa de la VCI.
Las mismas manifestaciones pueden ser secundarias a una compresión extrínseca severa o a un trombo tumoral en venas suprahepáticas o/y VCI.
La obstrucción venosa de salida elevará la presión en los sinusoides hepáticos disminuyendo el flujo venoso portal.
Como consecuencia habrá una congestión centrolobulillar seguida de una necrosis y atrofia.
El grado de necrosis vendrá dado por la agudeza de la obstrucción.
- Fase aguda: Las redes venosas colaterales aún no se han formado y la necrosis celular se desarrolla rápidamente.
El lóbulo caudado no ha tenido tiempo de hipertrofiarse.
Fase arterial hipo/heterogéneamente hipoatenuante (por el éstasis sinusoidal y portal) con área central de captación (lóbulo caudado) “en abanico”.
En la fase portal se verá un patrón en flip-flop con hipoatenuación de la parte central (por el lavado) mientras aumenta el flujo periféricamente.
Fig. 27
- Fase crónica: Los cambios de perfusión son mínimos y ocurrirán cambios morfológicos tales como en la cirrosis con hipoatenuación lineal o irregular Fig. 28 y nódulos de regeneración.
El desarrollo de nódulos regenerativos de gran tamaño,
la forma macroscópica de la hiperplasia nodular regenerativa,
ocurre como respuesta a la hipoperfusión que lleva a una atrofia con hiperplasia nodular compensatoria en las áreas que existe un aporte de flujo adecuado.
Los nódulos tendrán una captación homogénea sin o con anillo hipoatenuante en fase arterial y permanecerán hiperatenuantes en fae portal.
Tamaño de 1-4cm.
La visualización de colaterales venosas es sugestivo de un SBC crónico.
- Las distintas fases pueden mostrar apariencia similar.
Un SBC parcial puede ser asintomático si existe una función hepática conservada por una vena de drenaje dominante.
El reconocimiento de colaterales veno-venosas intrahepáticas es muy importante y a veces la única clave para el diagnóstico.
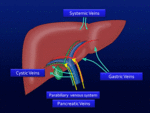
3) Tercer INFLOW (aporte venoso no-portal hepático)
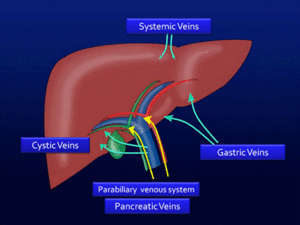
Fig. 29: Diagrama de áreas hepáticas de “tercer inflow”.
References: Hyun-Jung Jang, Korosh Khalili, Hojun Yu, Tae Kyoung Kim Perfusion and parenchymal changes related to vascular alterations of the liver Abdom Imaging (2011) DOI: 10.1007/s00261-011-9767-0
Pequeñas áreas hepáticas pueden tener un aporte venoso NO-portal.
Las variante típicas son:
- Vena gástrica derecha a segmento dorsal IV. Fig. 30
- Vena gástrica izquierda (v coronaria) a segmento II.
Fig. 31
- Vena cística a fosa vesicular.
- Venas pancreáticas a segmento IV dorsal.
Estas venas pueden formar un sistema venoso parabiliar en el ligamento hepatoduodenal .
También venas sistémicas como la epigástrica puede suplir la superficie anterior del segmento IV.
Fig. 32 Fig. 33 Fig. 34
El aporte venoso portal de dichas áreas está disminuído o prácticamente ausente mientras que el flujo arterial no se verá afectado debido al fénomeno del "tercer inflow".
Durante la fase arterial las DAHTs se verán frecuentemente debido al contraste que procede del tercer inflow que,
en condiciones normales,
llegará antes que el flujo venoso portal debido a que este último regresa del territorio intestinal.
Este flujo persistente que contiene diferentes factores hormonales y nutricionales respecto al flujo portal,
causará depósito o preservación grasa dependiendo de cual sea la vena aferente.
Las DAHT vendrán determinadas por la combinación del tiempo del "tercer inflow" y el grado de cambios metabólicos.